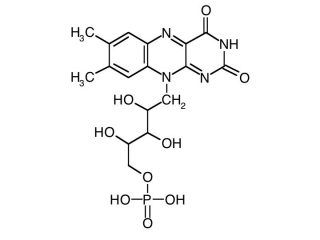
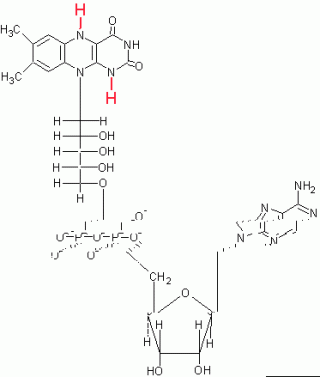
 La Flavina Adenina dinucleotide FAD è la forma ossidata di un gruppo protetico che partecipa alle reazioni di ossidoriduzione con specifica azione sui legami Carbonio-Carbonio.
La Flavina Adenina dinucleotide FAD è la forma ossidata di un gruppo protetico che partecipa alle reazioni di ossidoriduzione con specifica azione sui legami Carbonio-Carbonio.
Quando si ossida, Flavina Adenina dinucleotide si riduce a FADH2.
Esso è legato fortemente alla proteina in cui si trova come nel ciclo di Krebs o nella Beta ossidazione degli acidi grassi.
Nel caso del ciclo di Krebs il FAD si trova all’interno della catena di trasporto di elettroni e costituisce quello che è chiamato Complesso II.
La Flavina Adenina dinucleotide FAD prende due elettroni dallo ione succinato trasformandosi in FADH2 e forma lo ione fumarato che è un acido alfabeta insaturo.
Il centro reattivo di questo coenzima è il gruppo flavinico o anche anello isoallosazinico.
Si notino due doppi legami C=N coniugati.
succinato + E–FAD → fumarato + E–FADH 2
Il destino del FADH2 è poi di essere ossidato a E-FAD da un ossidante più energico come l’ubichinone che così ripristina l’ossidante.
Nel ciclo di Krebs l’enzima che ospita la Flavina Adenina dinucleotide è il succinato deidrogenasi
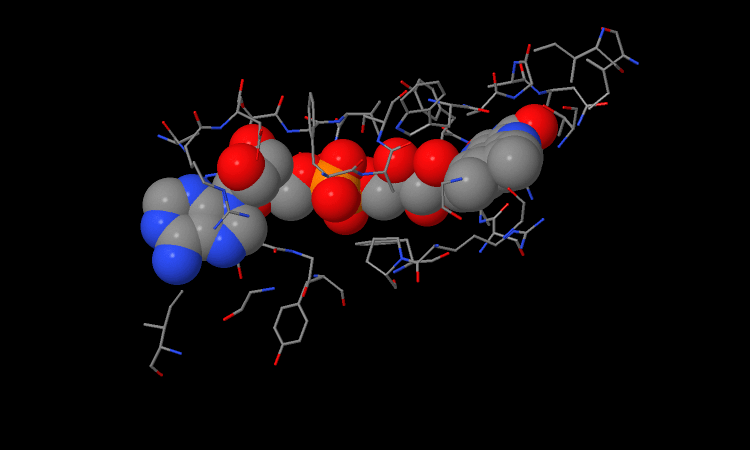
(File originale della molecola enzimatica la si trova dal Prof Jakubowsky)
Vediamo prima la struttura .
Questo è il gruppo responsabile dell’ossidazione dei legami C-C. Il centro di reazione lo possiamo vedere premendo . Quest’altro è il gruppo che ancora il gruppo nel sito attivo dell’enzima.
Vediamo ora il FAD all’interno di un enzima
||