La mioglobina fu la prima proteina di cui fu determinata la sua struttura atomica e di cui si conosce come sia immagazzinato l’Ossigeno nelle cellule del muscolo.
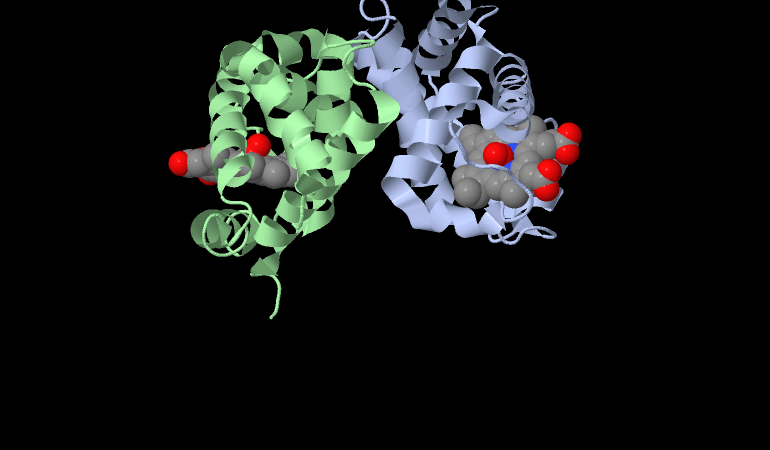
E’ una proteina capace di legare il Ferro e l’Ossigeno e la si ritrova nei tessuti muscolari dello scheletro dei vertebrati e in quasi tutti i mammiferi.
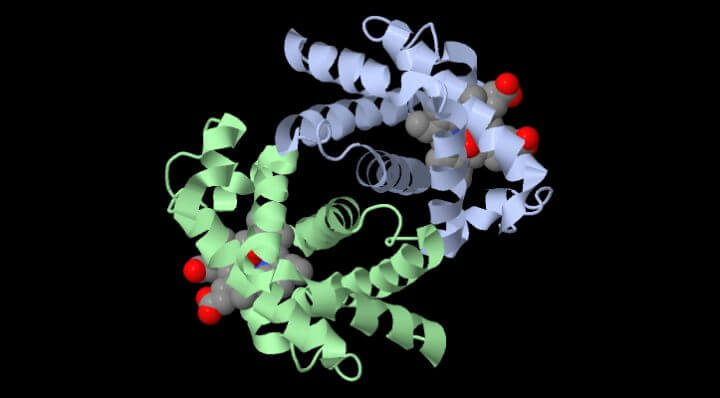
Rispetto all’Emoglobina ha una maggiore affinità per l’Ossigeno verso cui non presenta la cooperatività di legame, ma al suo centro è una proteina che come la emoglobina è capace a legare l’Ossigeno attraverso un gruppo EME.
Quando la miaglobina porta legato un Ossigeno molecolare conferisce il color rosso carne fresco che è dovuto al complesso FeII O2. Quando col passar del tempo il FeII è ossidato a FeIII si ha l’imbrunimento della carne. Una pratica di frode può essere di aggiungere nitrito Potassico o Sodico per ridurre il FeIII a FeII e ripristinare il colore rosa della carne.
Nell’uomo la si ritrova nel sangue solo dopo un danno muscolare, mentre in animali che possono trattenere il respiro per un lungo tempo la sua concentrazione nel muscolo è maggiore, come le balene.
Quindi da qui comincia lo studio della struttura delle proteine. Nel 1960 John Kendrew ed il suo gruppo di lavoro riuscirono a determinarne la struttura, della mioglobina.
E’ una piccola proteina comune nelle cellule dei muscoli e conferisce alla carne il colore rosso. Il suo compito è di immagazzinare l’Ossigeno da usare quando il muscolo lavora.
Per fare questo usa un mezzo chimico speciale per catturare lo sfuggente ossigeno: è il gruppo eme.
Questo ha la forma di un disco con un buco al suo centro adatto per tenere un atomo di ferro che con l’ossigeno dà luogo ad una interazione forte.
Il gruppo eme è tenuto legato all’interno di una pozza proteica su un lato della proteina.
Testo originale qui
Poi mostriamo l’occupazione dell’atomo di Ferro da una molecola di Monossido di Carbonio.
La mutazione di un solo amminoacido nelle catene beta da acido glutammico a Valina produce una forma di emoglobinaS tipica della Anemia falciforme
Si notano le . Si noti una molecola di O2 in Rosso al centro del gruppo Eme.
Ai due lati di ogni molecola piatta del gruppo Eme si possono notare due catene laterali di istidina che tengono il ferro da una parte e l’O2 dall’altra.
Esaminamo come sono distribuiti i residui idrofobici (in grigio) ed idrofili o polari in giallo:
I sono sepolti all’interno della proteina, mentre i sono fuori al contatto con l’acqua.
Quando nell’ambiente esiste il Monossido di Carbonio C=O, questo può legarsi all’atomo di ferro del gruppo eme, nella mioglobina come nell’emoglobina, bloccando così il trasporto dell’ossigeno o la sua assunzione.
Ora visualizza Colora