1- Si genera prima l’elettrofilo E+ con l’aiuto di un acido di Lewis
2- L’elettrofilo E+ attacca l’anello benzenico distruggendo l’aromaticità e formando l‘intermedio di Wheland
3- Una specie basica si riprende un H+ dall’intermedio di Wheland portando alla formazione di una specie aromatica, termodinamicamente più stabile.
Nella pagina qui indicata si può vedere il meccansimo di reazione con il grafico energetico relativo. Si noti che nel grafico energetico non è compresa l’energia per generare l’elettrofilo. Per approfondire si può andare qui.
si forma in seguito all’attacco di una specie elettrofila forte all’anello benzenico di cui rompe l’aromaticità. In questo caso si tratta di un H+. Si noti che il C che ha legato H+ è diventato teraedrico.
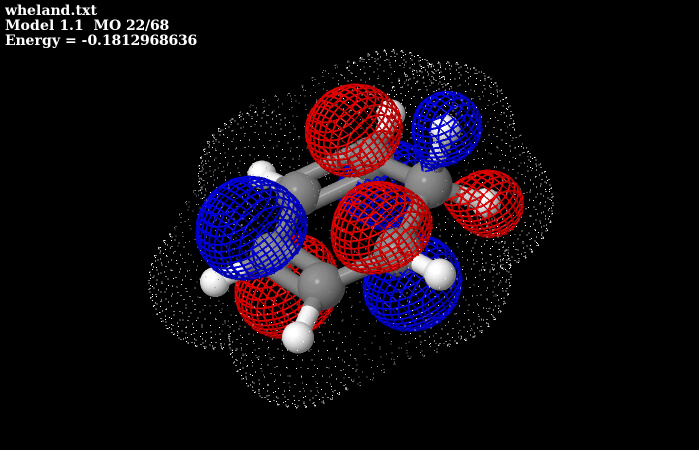
Con questo pulsante visualizziamo l’Orbitale Pgreca a più bassa energia, delocalizzato su 5 atomi di C. Come si vede la molecola NON è aromatica
Questo è il primo orbitale non occupato da elettroni
Questo è l’orbitale molecolare OCCUPATO a più alta energia
Le mappe di densità elettronica
.
Il è un acido di Lewis usato come catalizzatore nelle Sostituzioni Elettrofile Aromatiche sia per le Alchilazioni che acilazioni di Friedel Kraft.
Dalla sua MEPsi può notare come Al porti una vacanza elettronica che giustifica il suo comportamento chimico