Il termine cinetica enzimatica implica uno studio della velocità di una reazione catalizzata da enzimi e dei vari fattori che possono influenzarla.
Al cuore di ogni studio di una cinetica enzimatica sta la conoscenza del modo in cui viene cambiata la velocità di reazione con la variazione di concentrazione del substrato e dell’enzima e dell’apparato matematico sottostante.
Per facilitarci il compito assumeremo che l’enzima in discussione non abbia particolari proprietà, come le proprietà allosteriche, e che catalizzi la reazione che da un solo substrato porta ad un solo prodotto.
Inoltre il substrato deve arrivare all’enzima e allontanarsi da esso per sola diffusione, in assenza da inibizioni da prodotto o da substrato.
Questo potrà sembrare un caso tutt’altro che reale, dal momento che dopo tutto sono pochi quegli enzimi ad avere un solo substrato, ma così si ha una base per poter lo studio di sistemi più complessi.
Effetti della concentrazione del Substrato sulla Velocità della cinetica enzimatica
Curva concentrazione del Substrato contro Velocità
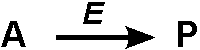
Una reazione di cinetica enzimatica può essere schematizzata da una equazione come questa di sù, dove A è il Substrato, P il prodotto della reazione, E l’enzima. Invece con quest’altro equilibrio più completo
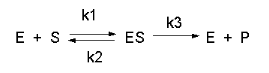
raffiguriamo sia gli equilibri di associazione/dissociazione sia l’esistenza di una k3 o costante catalitica.
In una reazione chimica non catalizzata ci aspetteremmo che la velocità di reazione sia direttamente proporzionale alla concentrazione del substrato, cioè al raddoppio della concentrazione del substrato raddoppierebbe pure la velocità. Ciò è dovuto ad un fatto puramente statistico, in quanto con il raddoppio delle molecole totali raddoppiano anche le molecole che hanno energia utile.In questo caso si ha una linea retta in un grafico Velocità concentrazione.
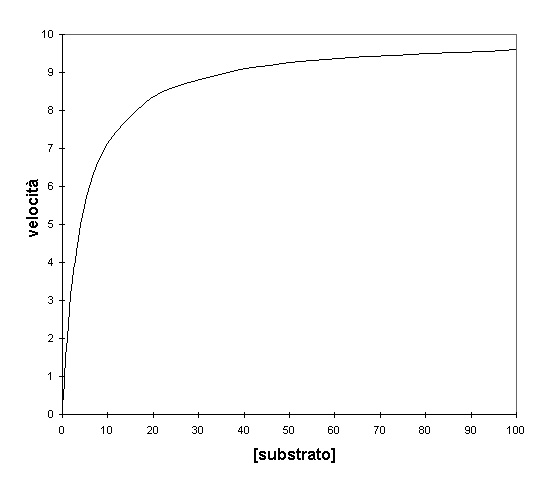
In una reazione catalizzata da un enzima, invece, il grafico della velocità contro la concentrazione di un reagente cambia al variare della concentrazione del substrato e perciò non può essere una retta ma deve essere una curva del genere
L’Equazione di Michaelis
Perché la curva v/[A] ci dia informazioni sulle proprietà dell’enzima e il modo in cui risponde al suo ambiente nella cellula, abbiamo bisogno di comprendere le basi matematiche sottostanti.
Per quanto attiene alle base matematiche ed al concetto di STATO STAZIONARIO ipotizzato nella trattazione matematica ci si può riferire a questo sito
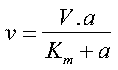
Il grafico che stiamo considerando non è una linea retta, ma è un’iperbole rettangolare la cui equazione è alquanto più complicata, da cui comunque è possibile mediante delle trasformazioni ricavare delle informazioni utili. Le nostre conoscenza sono basate sui lavori da pionieri Michaelis e Menton e di Briggs e Haldane. L’equazione prende il nome dalla prima coppia e può essere scritta in molti modi, di cui il più noto è
La velocità massima (Vmax)
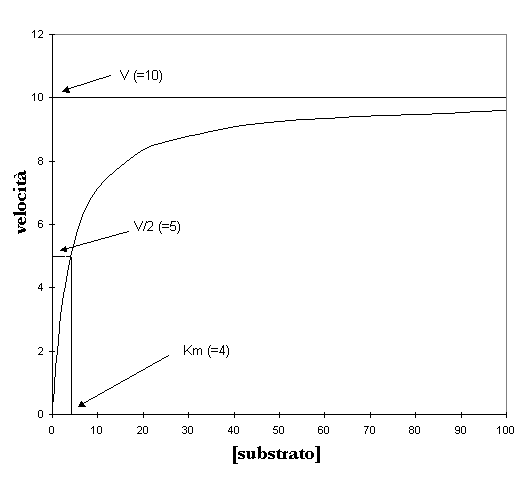
La costante V è conosciuta come Velocità massima o limitante della reazione e si ha ad alte concentrazioni di substrato. Come visto la pendenza del grafico v contro A diviene sempre minore con l’aumentare di [a] e perciò ci deve essere un valore massimo di velocità che non potrà mai superare indipendentemente da quanto grande diventa la concentrazione del substrato.
Osservando il grafico a V=10 vediamo una linea orizzontale che attraversa il grafico che rappresenta per questo enzima la velocità massima.
Come si può notare dal grafico v cresce sempre più ma non raggiunge mai il valore di Vmax che rappresenta da un punto di vista matematico un asintoto.
Rappresenterebbe il valore che avrebbe la velocità qualora la concentrazione del substrato fosse infinita.
Perché è importante conoscerne il valore? Ad elevate concentrazioni di substrato lo stadio limitante della reazione è quello della conversione del complesso attivato nel prodotto.
Dal momento che Vmax è la velocità a concentrazione di substrato infinita essa deve essere uguale alla velocità dello stadio limitante e così rappresenta una misura diretta della abilità dell’enzima a convertire il substrato in prodotto.
La Costante di Michaelis (Km)
La costante di Michaelis, Km, è definita come la concentrazione del substrato che causa una velocità uguale alla metà di quella massima. Questo viene evidenziato sul grafico. Al valore di V/2 una linea verticale taglia l’asse delle ascisse al valore 4 dandoci così il rispettivo valore di Km.
Sembra una definizione semplice ma può sembrare alquanto arbitraria. Perché sarebbe interessante per noi? Per comprendere ciò dobbiamo considerare la formazione del complesso enzima substrato un po’ più in dettaglio.
Ricordiamo che l’enzima lega il substrato mediante legami deboli che si rompono facilmente dando luogo a reazioni reversibili. Substrato, enzima e complesso si troveranno in uno stato di equilibrio. Prendendo in esame ad un certo istante le molecole dell’enzima, troveremo che una parte di esse si troveranno sotto forma di enzima libero, mentre la parte rimanente sotto forma di complesso Enzima substrato. La posizione di questo equilibrio dipende dalla concentrazione di substrato che sposta verso destra l’equilibrio. Ad alte concentrazioni l’enzima è saturato e si troverà sotto forma di complesso e la velocità raggiungerà il suo massimo. Nel punto in cui metà delle molecole di enzima sono saturate la velocità sarà la metà della Vmax.

Ma la posizione dell’equilibrio dipende anche dalla forza dei legami che si instaurano tra substrato ed enzima: più essi sono deboli più alta deve essere la concentrazione del substrato necessaria per avere il 50% della saturazione e la Km sarà elevata. Di contro a legami più forti la concentrazione del substrato per raggiungere il 50% della saturazione potrà essere inferiore e si avrà una Km inferiore
Perciò la Km ci dà informazioni sulla forza di legame substrato enzima o come viene chiamata affinità. Tra affinità e Km c’è una relazione inversa: alta affinità è data da un basso valore di Km. Bassa affinità è data da un alto valore di Km.
Km comunque è una misura approssimata ma ragionevole di tale affinità la cui misura è data da Ks che però è difficile da misurare.
Analisi dell’equazione di Michaelis Menten e dei parametri cinetici
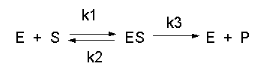
L’equilibrio sotto rappresentato è usato nel trattamento matematico per ricavare l’espressione della Michaelis Menten. K1 e K2 sono costanti di associazione e dissociazione del substrato sull’enzima; K3 è la costante catalitica. ES rappresenta il COMPLESSO ENZIMA SUBSTRATO che poi evolve a dare il prodotto.
Dal trattamento matematico secondo il modello dello stato stazionario, che afferma come ES deve essere costante durante la reazione enzimatica, si ricavano alcuni punti importanti.
Secondo questo modello l’equazione di MM diventa:
Equazione MM teorica v = Vm(A)/(Km+ A)
La prima cosa che si nota è che (k2 + k3)/k1 è costante e dipende da costanti importanti che rappresenta la costante di Michaelis Menten KM.
Poi in condizioni di A (substrato) molto elevate, si può trascurare Km rispetto ad A e l’equazione si trasforma nella v= k3*E0 dove E0 rappresenta la concentrazione analitica dell’enzima. Il prodotto è quindi una costante che coincide con Vmax.
Quando A >> Km, v=Vm = k3E0. Siamo nel tratto di saturazione della cinetica quando tutti i siti attivi sono al lavoro. la v deve essere Vmax. k3 è anche numero di turnover.
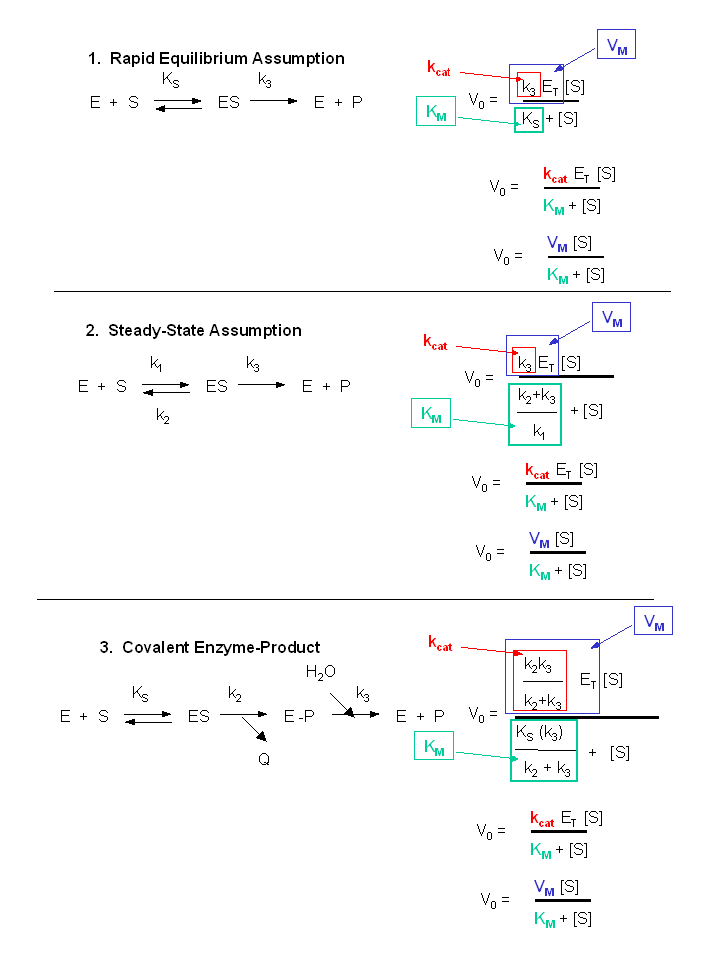
Quando A = Vmax/2, allora A = Km. Per un enzima terziario la KM è la concentrazione del substrato che fa raggiungere la Vmax dimezzata.
Riassumendo (tenendo conto che A coincide con S dell’immagine)
Effetti della Concentrazione dell’Enzima
Abbiamo visto che la concentrazione del substrato influenza la velocità di una reazione enzimatica che non senza ragione sarà influenzata anche dalla concentrazione dell’enzima. Ora esamineremo come quest’ultima influenza i due parametri cinetici Vmax e Km.
Vmax è la velocità di reazione ad alta concentrazioni, di saturazione, del substrato. In tali condizioni ogni molecola di enzima avrà una molecola di substrato legata a sé e starà interagendo con esso per originare il prodotto alla velocità più alta possibile.
Raddoppiando le molecole di enzima avremmo il doppio di molecole di substrato legate all’enzima e ci si aspetterebbe un raddoppio della velocità, come è in realtà: Vmax è direttamente proporzionale alla concentrazione dell’enzima.
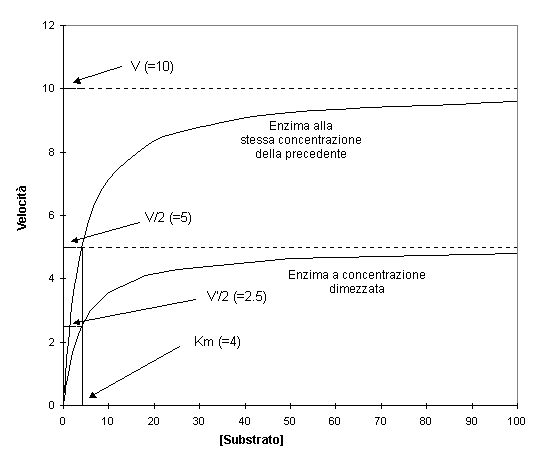
In questo grafico abbiamo dimezzato la [E] per cui si dimezza la Vmax, da 10 a 5. Km ci dice dell’affinità dell’enzima per il suo substrato. Cambiando il numero di molecole di enzima non influenza il suo comportamento chimico individuale né in meglio né in peggio. Di conseguenza Km è indipendente dalla concentrazione dell’enzima, come viene dimostrato dal grafico di su. Riducendo del 50% la [S] V max scende in proporzione, ma il valore di [S] a Vmax/2 è sempre lo stesso. Quindi Km è indipendente dalla [S]
Test a scelta Multipla su Cinetica Enzimatica