La papaina, definito con E.C. 3.4.22.2, ha un’attività enzimatica ottimale tra il pH 6 e pH 7, alla temperatura ottimale i 65° e presenta un Punto Isoelettrico pI di 8,75 e 9,55. Esibisce azione di endo ed esopeptidasi, di amidasi ed esterasi.
La papaina ha valori Km e Vmax attorno a 4×10-3M e 54µmol/min/mg rispettivamente.
La papaina della papaya ha tantissime applicazioni commerciali nel campo della concia del cuoio, ne tessuti, nei detergenti, nell’industria farmaceutica ed alimentare. In quest’ultimo campo è anche usato, non dovunque, per intenerire le carni.
La sua estrazione è fatta in gran parte dal lattice del frutto poco maturo più che dalle altre parti. Il contenuto di papaina nel frutto decresce col grado di maturazione del frutto stesso.
La papaya verde è anche il componente principale di un piatto famoso thailandese.
Lo studio degli enzimi allo scopo della detergenza ha portato l’attenzione anche sulla papaina per la sua stabilità ad alte temperature dal momento che la sua temperatura ottimale è attorno ai 65 °C. E’ anche usata come sbiancante dei denti.
Indagini strutturali sulla Papaina
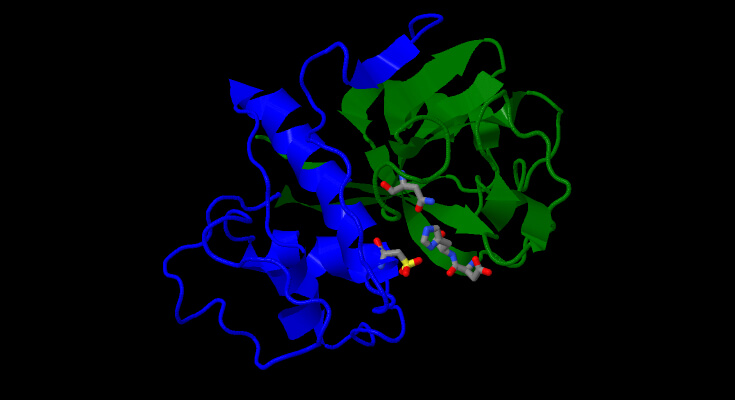
La catena di 212 amminoacidi si organizza in due domini che costituiscono nel loro mezzo il sito attivo dell’enzima cisteinico.
I legami ad Idrogeno presenti nella ALFA ELICA hanno una lunghezza di 2,98A superiori al classico 2,89A, mentre nelle beta a pieghe antiparallele le lunghezze di legame sono abbastanza varie con una media di 2,91 A.
Come si vedrà nell’immagine 3d di dopo, la struttura terziaria è tenuta insieme da alcuni ponti salini, da 3 legami a disolfuro, da alcuni legami ad H e da alcune interazioni idrofobiche nella zona di contatto dei due domini e da alcuni legami ad idrogeno tra residui vicini.
La somma totale di tutte queste interazioni permette ad i due domini che costituiscono insieme il sito attivo di non allontanarsi.
Il sito catalitico è costituito da tre amminoacidi Cis-25, His-159 e Arg-175. Mentre i primi due sono quelli che effettuano la catalisi, si è notato che l’attività catalitica scende a livelli minimi se l’arginina 175 viene sostituita da un altro amminoacido.
La struttura globulare della papaina la si capisce dalla presenza di molti residui idrofobici che in ambiente acquoso devono essere seppelliti all’interno della proteina stessa.
– –
Elementi Strutturali della Papaina
– –
In quest’altra visualizzazione poniamo in rosa sono rappresentati gli AA che danno i ponti salini.