Può essere composta da uno o più domini che rappresentano un’organizzazione di più secondarie con una specifica funzione biologica.
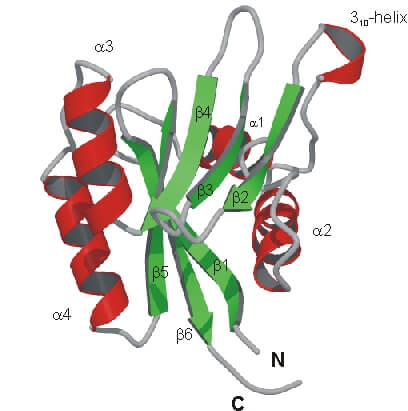
La struttura terziaria è tenuta assieme da vari legami in genere non covalenti di varia forza.
| Tipo di Legame | (kcal/mole) |
|---|---|
| Covalente | -50 to -100 |
| Ionico | -80 or -1 |
| Legame ad Idrogeno | -3 to -6 |
| Van der Walls | -0.5 to -1 |
| Interazione idrofobica | -0.5 to -3 |
Un componente essenziale sono leInterazioni idrofobiche che è il nome dato alla forza, determinata dall’entropia, che spinge alla autoassociazione dei gruppi non polari o di molecole non polari in ambiente acquoso.
La ragione è che le molecole idrofobe tendono a minimizzare il contatto con l’acqua, mentre l’acqua da parte sua non è costretta ad assumere configurazioni rigide a basso valore di entropia causate dalla formazioni di legami ad Idrogeno.
Le deboli interazioni dei gruppi non polari tra loro e con l’acqua sono approssimativamente uguali, ma si perde un valore consistente di entropia se ogni gruppo idrofobico si trovasse ingabbiato da uno strato di molecole di acqua legate tra loro con legami ad idrogeno.
L’auto associazione di questi gruppi non polari libera queste molecole alla massa del solvente. Vari studi mostrano che le proteine si organizzano per limitare la superficie accessibile al solvente per i gruppi non polari. Dal grafico che viene dopo si vede come le catene laterali degli amminoacidi non polari tendano ad essere sepolti nell’interno della struttura proteica.
Va considerato che i diversi amminoacidi si distribuiscono all’interno della proteina secondo la loro catena laterale: gruppi acidi o basici o polari tenderanno a trovarsi per lo più nelle aree dove è possibile un contatto con l’acqua, mentre quelli apolari tenderanno ad essere sepolti nel cuore della proteina per le stesse ragioni entropiche discusse per le micelle.
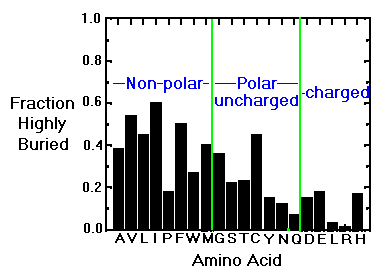 Qui è visualizzata la distribuzione media degli AA, come frazione di AA sepolti nella proteina. Si noti che quelli apolari sono maggiormente presenti nel cuore idrofobico, con eccezione della prolina che occupa in genere i gomiti e i giri delle proteine. L’alta presenza invece della cistina nella parte sepolta è per la capacità di formare ponti disolfuro che stabilizza la struttura terziaria.
Qui è visualizzata la distribuzione media degli AA, come frazione di AA sepolti nella proteina. Si noti che quelli apolari sono maggiormente presenti nel cuore idrofobico, con eccezione della prolina che occupa in genere i gomiti e i giri delle proteine. L’alta presenza invece della cistina nella parte sepolta è per la capacità di formare ponti disolfuro che stabilizza la struttura terziaria.
Oltre l’effetto idrofobico sono presenti vari tipi di legami:
- Legami ionici o ponti salini tra gruppi acidi caricati negativamente e gruppi basici caricati positivamente appartenenti a catene laterali;
- Legami ad Idrogeno tra COOH e NH2 di differenti catene laterali;
- forze idrofobiche tra i gruppi apolari specie nell’interno della proteina
- ponti a disolfuro tra gruppi di cistina
- eventuali legami covalenti con gruppi protestici come l’eme nella miosina o emoglobina, o con lipidi o carboidrati
Strutture terziarie in Jmol. Qui cominciamo vedendo come sono disposti i vari tipi di AA all’interno di una alfa elica parte di una apoliproteina.
Nelle animazioni seguenti esaminiamo i vari tipi di legami e interazioni che portano alla struttura terziaria per una chimotripsina partendo da una catena interna. In una seconda fase studieremo un caso di elica anfipatica.
– – –
Interazioni elettrostatiche
– – – – –
Interazioni Idrofobiche
–
Struttura terziaria delle proteine: elica anfipatica
Questa elica è una struttura di ELICA ANFIPATICA, ha cioè una parte più idrofobica dove sono preponderanti gli AA con residui idrofobici, ed una parte più idrofila dove prevalgono gruppi polari e/o ionici.
Spesso le due parti sono rivolte in modo da massimizzare i legami e da minimizzare l’ordine di molecole di acqua di solvente.
Con questo link si dell’elica e si noterà che sull’altro lato il numero di gruppi polari o ionici in Rosso che sono molto di meno.
Questo è un caso tipico, sia per le eliche che per le beta a pieghe, di avere due parti:
una ed una cioè una struttura anfipatica, proprietà che è messa meglio in luce con la colorazione differente delle due parti.
In quest’altra visualizzazione possiamo mettere in luce i volumi dei gruppi differenti.
Le stesse catene in CPK . Ruota .