L’enzima Piruvato Deidrogenasi E1 è uno dei tre componenti principali di un complesso a più enzimi chiamato Piruvato Deidrogenasi, a cui partecipano anche l’enzima E2 diidrolipoil transacetilasi ed E3 Diidrolipoil deidrogenasi.
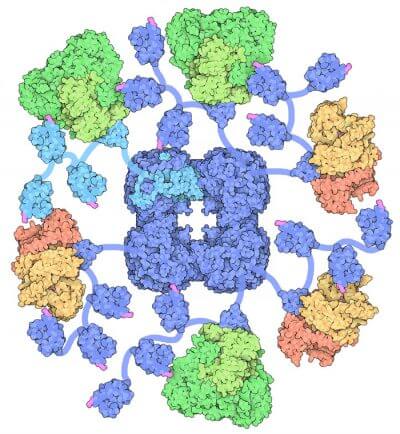
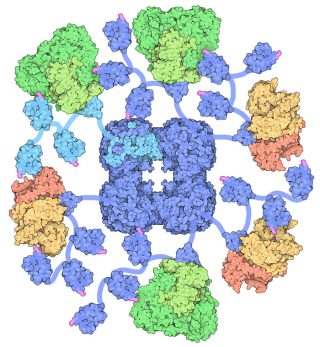
Il complesso enzimatico Piruvato Deidrogenasi dell’Escherichia Coli ha un peso di 4600 kD ed un diametro attorno ai 300 angstrom.
Il cuore della particella è costituito di 24 proteine E2 sistemate a cubo, che è circondato da 24 proteine E1 e 12 proteine E3.
Questi enzimi nel complesso sono responsabili della sintesi dell’AcetilCOenzima A a partire dallo ione Piruvato, stadio precedente all’entrata nel ciclo di Krebs.
Il complesso Piruvato Deidrogenasi lega perciò il ciclo metabolico della glicolisi a quello del Krebs, detto anche ciclo dell’acido citrico.
Questo enzima gioca un ruolo fondamentale del ciclo di Krebs a cominciare dal fatto che rappresenta il solo percorso biologico della sintesi dell’AcetilCoeA dal pirvuato. Questa reazione deve essere perciò molto controllata.
Un metodo di regolazione è l’inibizione da prodotto da NADH e AcetilCoeA. NADH è il prodotto di reazione dell’Enzima E3, diidrolipoil deidrogenasi, mentre AcetilCoeA è un prodotto della E2. Entrambi competono per il sito attivo dei loro enzimi. NADH compete con NAD+ per sito attivo di E3 mentre AcetilCoeA compete con CoA su E2.
Alti livelli di NADH mantengono E3 nella forma ridotta e quindi il gruppo lipamide di E2 è nella forma ridotta che impedisce a E1 di trasferire il gruppo idrossietile ad E2. Di conseguenza l’attività di E1 è ridotta.
In modo simile AcetilCoeA riduce l’attività di E1 occupando il sito attivo impedendo al piruvato di entrare.
Alte concentrazioni relative di NADH e AcetilCoeA quindi regolano la attività di E1 attraverso l’inibizione da prodotto.
Il controllo di questo processo è anche affidato ad alcune chinasi che fosforilizzano e defosforilizzano i residui serinici dell’enzima E1 negli organismi eucarioti e nell’essere umano. AcetilCoeA e NADH controllano anche questi altri enzimi.
Cominciamo visualizzando le molecole necessarie all’enzima per poter funzionare che sono
– – e .
Visualizza l’enzima che nel caso dell’Escherichia coli è un omodimero come visualizzato qui .
I gruppi leganti dei cofattori si trovano all’interfaccia delle due unità monomeriche. Si notino il bloccati dagli amminoacidi