Il concetto di ossidazione in Chimica Organica è qualcosa di leggermente diverso dallo stesso concetto in Chimica Generale.
In chimica organica l’ossidazione comporta il trasferimento di uno ione Idruro, cioè di un Protone e di due elettroni ed è anche chiamata Deidrogenazione, mentre l’operazione inversa è una Idrogenazione.
In chimica generale l’ossidazione è il semplice trasferimento di elettroni dal riducente verso l’ossidante.
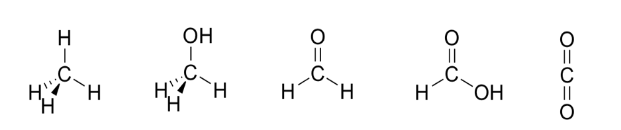
Dal più ridotto – – – – – – – – – – – – – al più ossidato
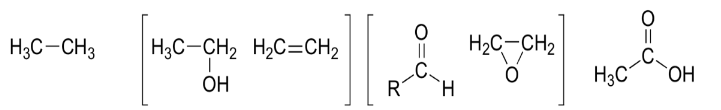
Dal più ridotto – – – – – – – – – – – – – al più ossidato
Ossidazione degli Alcoli
L’ossidazione degli alcoli è una via sintetica molto importante per ottenere altri tipi di gruppi funzionali o per costruire legami C-C.
Possiamo ossidare in modo semplice gli alcoli Primari e secondari, mentre gli alcoli terziari sono resistenti ai normali ossidanti che non coinvolgono rottura di legami C-C.
Nella ossidazione viene estratta formalmente una molecola di H-H, un idrogeno legato all’Ossigeno che lascia il suo elettrone, e un Idruro che esce con un doppietto elettronico.
Quest’ultimo passaggio è anche lo stadio lento dell’ossidazione e se non è presente un H sul C la reazione di ossidazione non può avvenire come nel caso degli alcoli terziari oppure di eteri.
Ne consegue che un alcol primario può essere ossidato ad Aldeide che successivamente è ossidata ad acido carbossilico.
Con particolari reagenti e/o condizioni è possibile fermare l’ossidazione dell’aldeide che viene prima trasformata ad aldeide idratata. E’ quest’ultima che viene ossidata.
Il reagente più comune nell’ ossidazione degli alcoli è il reagente di Jones
Il reattivo di Jones è costituito da Anidride Cromica CrO3 in presenza di H2SO4 e Acetone oppure di Bicromato Potassico.
In questo caso se non si ha l’accortezza di aggiungere il reagente all’alcol mentre si distilla il prodotto, si rischia di giungere direttamente alla formazione dell’acido carbossilico corrispondente.
Durante la reazione si ha la formazione di un estere cromico che poi evolve verso la formazione dell’aldeide. Il Cromo dallo stato di ossidazione +6 passa prima a +4 che evolve a +3, di colore verde.
La reazione bilanciata scritta per formare un chetone è la seguente
2 HCrO4− + 3 RR’C(OH)H + 8 H+ + 4 H2O → 2 [Cr(H2O)6]3+ + 3 RR’CO
La reazione bilanciata scritta per formare un acido a partire dall’aldeide è la seguente
4 HCrO4− + 3 RCH2OH + 16 H+ + 11 H2O → 4 [Cr(H2O)6]3+ + 3 RCOOH
Reattivo di Collins
Per ottenere un’ossidazione ad aldeide più sicura e completa si può usare il reagente di Collins che a differenza del Jones non contiene acqua derivante dall’acido solforico e non è igroscopico perché è fatto in diclorometano
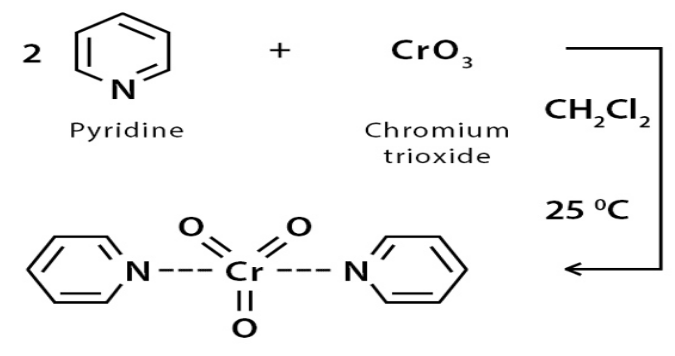
Reagente PCC
Un altro modo sicuro per ossidare gli alcoli primari ad aldeidi è quello di usare il PCC, CloroCromato di Piridinio, che è una versione meno reattiva dell’acido cromico e che si ottiene per addizione di CrO3 in HCl e successiva addizione di Piridina.
Meccanismo generale di Ossidazione di un alcol primario ad aldeide
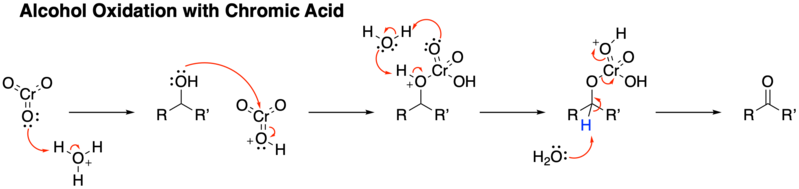
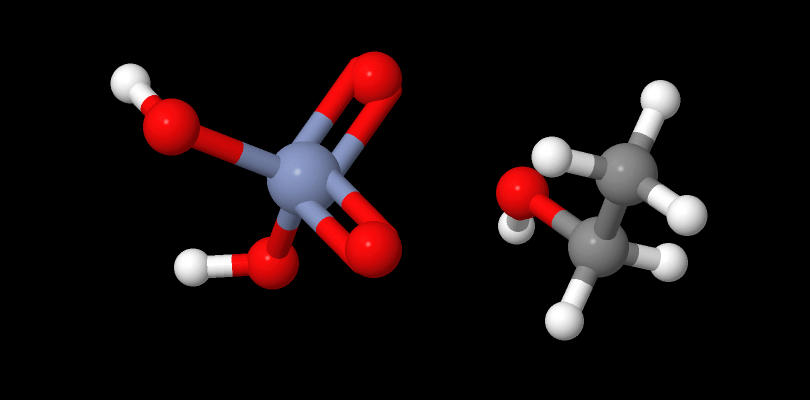
Animazione 3D dell’ossidazione ad aldeide con Acido Cromico
Prima parte del meccanismo di reazione prevede la formazione di un estere cromico
II parte
L’aldeide che si è formata può essere idratata da molecole di acqua presenti e subire un’ulteriore ossidazione ad acido carbossilico.
Se nell’ambiente non immettiamo H2O, la reazione si formerà allo stadio di aldeide.
Si può approfondire qui l’ossidazione in Chimica Organica a questo indirizzo