Perché reagiscono le molecole? Perché avvengono le reazioni chimiche?
La chimica che è la scienza del cambiamento ha la risposta in due suoi grandi capitoli: la termodinamica e la cinetica, due concetti fondanti della disciplina.
La termodinamica ci informa della stabilità energetica delle molecole. Essa tratta con il calore, il lavoro, la temperatura e delle loro interazioni con energia, radiazione e proprietà fisiche della materia
Ma come fa la termodinamica a dire perché le molecole reagiscono?
Ogni molecola ha una propria energia, chi maggiore e chi minore. Ogni sistema chimico evolverà nel senso di andare verso il punto di minore energia possibile, il suo punto più stabile.
Una molecola con alta energia, e quindi meno stabile, tenderà perciò ad evolvere o vorrà reagire per trasformarsi in un’altra molecola con minore energia e più stabile.
Perché si ha ciò? Perché il processo di andare verso uno stato di energia inferiore permette il rilascio di energia.
Si parla di processi esotermici e processi esoergonici.
Nel primo caso dei processi esotermici si ha rilascio di energia sotto forma di calore, mentre nel secondo caso si parla di diminuzione di energia libera di Gibbs che nei processi chimici è la grandezza naturale da tenere presente perché più completa.
Il processo termodinamicamente favorito è quello che procede con una diminuzione di Energia Libera di Gibbs (ΔG <0).
L’energia Libera di Gibbs G è composta di due termini: un fattore che tiene conto delle energie dei legami che si rompono e si formano, Entalpia ΔH, e fattore entropico, T*ΔS, che misura il cambiamento di organizzazione delle molecole, del disordine. S è la funzione di stato ENTROPIA.
ΔG=ΔH -T*ΔS
dove H è l’entalpia, T la temperatura assoluta e S l’entropia del processo
Esoergoniche sono le reazioni che avvengono con emissione di calore => ΔH<0
Endoergoniche invece sono le reazioni che avvengono con assorbimento di calore => ΔH>0
Le Reazioni più tipiche che avvengono con aumento di entropia ΔS>0 sono la combustione e l’evaporazione
Reazioni con diminuzione di entropia ΔS<0 solidificazione oppure le molecole di acqua a contatto con una catena apolare.
Poiché ΔG deve essere negativo in un processo spontaneo, ne consegue che reazioni con ΔH negativo e ΔS positivo saranno spontanee a qualsiasi temperatura.
Ne consegue anche che processi con ΔH positivo e ΔS negativo non saranno MAI spontanei a tutte le temperature.
Quando ΔH è negativo e ΔS anche negativo, ci sarà una temperatura di equilibrio a cui le due tendenze opposte si equivarranno e a T superiori si va verso l’impossibilità ΔG>0
Nel caso di ΔH positivo e ΔS positivo, aumentando la temperatura si porterà la reazione verso ΔG<0.
Stabilità termodinamica nei diagrammi energetici.
Nelle reazioni organiche il termine entropico molto spesso è molto inferiore numericamente a quello entalpico, e si preferisce riferirsi solo alla variazione di Entalpia.
In processi in cui sono coinvolte macromolecole in acqua, il termine entropico diventa di solito preponderante e quello entalpico invece può essere trascurabile, per cui la valutazione della spontaneità non è sempre facile.
Nei diagrammi che useremo parleremo in termini di entalpia, ma rigorosamente non è così.
Esaminiamo tre alcheni, 1-butene, cis-2butene e il trans-2butene.

Sappiamo dalla teoria degli alcheni che la scala energetica dei tre è proprio 1-butene>cis-2butene> trans-2butene.
Dal grafico notiamo che per andare dal cis2butene al 1-butene sono necessarie 10 kcal/mole, mentre per andare al trans-2butene si sviluppano 15 kcal/mole.
Questo ci fa dire che il primo processo, trascurando il fattore entropico, NON è spontaneo, è termodinamicamente SFAVORITO, mentre il secondo è spontaneo, termodinamicamente FAVORITO.

Termodinamicamente favorito significa che il processo, date certe condizioni, avviene spontaneamente, e quindi 1-butene potrebbe trasformarsi in 2 cisbutene e poi in trans-2butene.
Se non ci sono le circostanze e le condizioni, questi composti restano nel loro stato, sono inerti. Perché?
La risposta al perché queste molecole reagiscono o meno sta nella cinetica chimica e nelle energie di attivazione corretate.
Cinetica Chimica e barriere della reattività chimica
La cinetica chimica ci dice la velocità con cui una data reazione procede, ci dice i passaggi che un reagente deve attraversare, e gli stati di transizione in cui si deve trasformare per diventare prodotto. Ci dice inoltre la temperatura minima per far partire la trasformazione.
Definiamo stato di transizione la struttura intermedia ipotizzata tra reagente e prodotto di un singolo passaggio di reazione. Esso ha energia superiore sia ai reagente che al prodotto.
La differenza di energia tra lo stato di transizione e il reagente è chiamata energia di attivazione, una barriera energetica che una molecola deve superare perché avvenga la reazione termodinamicamente favorita.
Più è alta l’energia di attivazione, quindi lo stato di transizione, meno molecole avranno quella energia e più lenta sarà la reazione.
La Cinetica chimica ci dice inoltre per reazioni non semplici qual’è il meccanismo di reazione, cioè la successione ordinata di processi più elementari che portano dai reagenti ai prodotti, e quale tra questi è lo stadio più lento che determina la velocità del processo.
Prendiamo ad esempio una reazione semplice come la SN2, sostituzione nucleofila bimolecolare, tra ione idrossido e clorometano, che è una reazione spontanea, cioè termodinamicamente favorita. Inoltre sappiamo che la reazione inversa non sarà possibile.
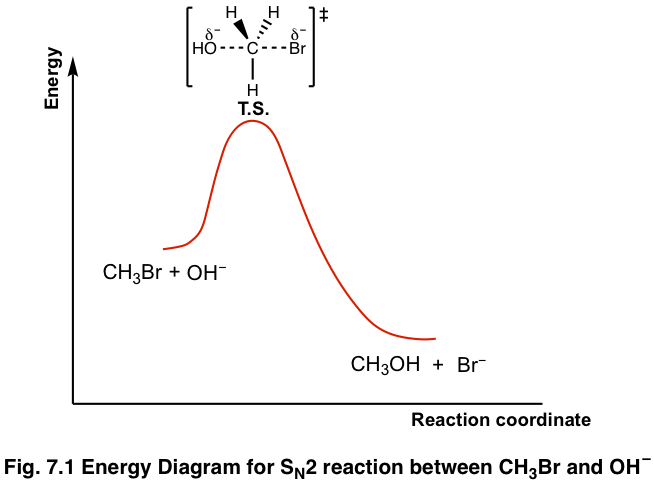
Ma la reazione avverrà a qualunque temperatura, appena mescoliamo i due reagenti?
No, i reagenti resteranno senza reagire se la temperatura è troppo bassa oppure se non è sufficientemente alta. Si può dire che le molecole non hanno l’energia sufficiente a quella temperatura per generare lo stato di transizione.
Per la reazione tra clorometano e ione idrossido si è visto che l’energia di attivazione ammonta a 23 Kcal/mole, mentre la differenza di entalpia tra reagenti e prodotti è di -25Kcal/mole.
Alla fine del processo, l‘energia di attivazione sarà interamente restituita all’ambiente, non si produce né si consuma.
Stabilità termodinamica contro inerzia chimica
In generale si può affermare che se l’energia di attivazione è maggiore di 30-40 Kcal/mole la reazione per quanto spontanea possa essere non avverrà in condizioni regolari e normali.
A questo punto possiamo differenziare due proprietà dei reagenti chimici: stabilità che è un carattere termodinamico, e inerzia chimica che è un concetto cinetico. Sono due concetti separati.
Una molecola può essere meno stabile del suo prodotto ma non per questo trasformarsi in esso. Può essere cioè meno stabile del prodotto però essere più inerte.
Si pensi al diamante e alla grafite: il primo è meno stabile della grafite, ma nessuno mai ha visto trasformare i diamanti in grafite a causa delle deformazioni dei legami chimici coinvolti.
Questa è anche la ragione per cui si possono immagazzinare reagenti senza paura che essi isomerizzino in composti più stabili.
Se una data reazione ha una barriera energetica molto grande da superare, la cinetica chimica ci dice anche come possiamo fare per abbassare o aggirare questa energia di attivazione elevata, in modo che possa avvenire in condizioni più blande o a formare prodotti più particolari.
Se la barriera energetica è per esempio di 50 Kcal/mole la reazione sarebbe tanto lenta da poter impiegare anni per poter vedere una conversione significativa.
La Catalisi chimica
Per aggirare questo ostacolo si usano i catalizzatori e/o gli enzimi che sono dei catalizzatori biologici che riescono ad abbassare l’energia di attivazione oppure a modificare il percorso della reazione.
Per esempio nelle ossidazioni condotte dallo ione permanganato, MnO4- si usa spesso lo ione manganoso Mn2+ che è quindi un catalizzatore: da notare che i catalizzatori non si formano né si consumano, ma partecipano alla reazione.
Riprendiamo una reazione classica della Chimica Organica, la sintesi del Bromo Benzene che avviene tra Br-Br e Benzene in presenza di FeBr3, tribromoferrico.
Quest’ultimo è un acido di Lewis ed agisce da catalizzatore nella sostituzione elettrofila aromatica. Se non mettiamo il catalizzatore probabilmente dovremmo alzare di molto la temperatura di reazione con costi e rischi connessi.
Il meccanismo di questa reazione prevede che il benzene si trasformi per primo in un Intermedio di Wheland, una specie chimica molto reattiva che non va confusa con lo stato di transizione.

Mentre l’intermedio è una molecola reale che può essere vista e determinata, lo stato di transizione è piuttosto una nostra elaborazione mentale di ciò che avviene.
L’intermedio di Wheland è sia una specie termodinamicamente instabile che cineticamente reattiva, e richiede una energia di attivazione per formarsi di circa 30 Kcal/mol. Una volta formatosi reagisce velocemente per dare i prodotti di reazione perché i passaggi successivi richiedono basse energie di attivazione e la reazione è favorita termodinamicamente. La reazione complessiva è esotermica per 11 Kcal/mol
Come possiamo favorire la reazione e farla avvenire in condizioni più favorevoli?
A giungere in aiuto come catalizzatori delle Sost Elet Arom ci sono i cosiddetti acidi di Lewis che entrano in gioco proprio nello stadio limitante della velocità, la formazione dell’intermedio di Wheland.
Nel nostro caso è FeBr3 che permette condizioni più blande di reazione perché la barriera energetica ora diventa più bassa. Inoltre non deve essere aggiunto in quantità stechiometriche perché non si consuma durante la reazione.
Non è mai troppo ribadire l’importanza dei catalizzatori chimici oppure degli enzimi nei processi chimici e industriali sia per le migliori condizioni di processo che per il tipo di prodotto in considerazione dei fattori di stereoisomeria di moltissimi composti chimici.