Gli alcani, tra i quali vi è il metano, sono idrocarburi composti da Carbonio ed Idrogeno, e sono composti saturi: hanno il massimo numero di idrogeni per ogni atomo di carbonio. La loro formula bruta è CnH(2n+2).
Il più semplice degli alcani è il metano che ha un solo atomo di C, il CH4, che alla pressione atmosferica è gassoso. Infatti bolle a pressione atmosferica a -161°C, mentre fonde a -182,7 °C.

La lunghezza di legame è circa 1,54±0,01 Å mentre l’energia di legame è di media 85±3 kcal/mol. L’angolo di legame H-C-H è 109°30′, il perfetto angolo tetraedrico.
Come si è definito che il Metano è una molecola tetraedrica e come si spiegano questi angoli e lunghezze di legame alla luce della configurazione elettronica degli orbitali atomici del C che è 1s2 2s2 2p2, sapendo che i quattro legami con l’H sono tutti equivalenti?
Che la configurazione elettronica di un atomo C isolato non sia soddisfacente, lo si capisce dal fatto che avremmo 3 legami C-H uguali ed uno diverso, con tre legami più lunghi (orbitali p) ed uno più corto. Questa ipotetica struttura porterebbe ad un piccolo momento di dipolo che non osserviamo. Di conseguenza gli orbitali naturali del C non spiegano nulla.
Anche una struttura planare del metano, con tutti i legami posti su un piano a formare angoli di 90° non soddisfa. Infatti non spiegherebbe la possibilità di avere molecole chirali, di molecole speculari e non sovrapponibili.
A proporre il C tetraedrico fu Jocobus Henricus van’t Hoff il quale fece notare che un C di questo tipo può spiegare l’esistenza di due isomeri ottici derivanti dal C asimmetrico, definizione sua, e spiegherebbe anche l’acido tartarico che era stato già osservato come esistere sotto forma di tre stereoisomeri, destrogiro, levogiro e meso.
Nel 1913 fu Bragg a risolvere la struttura del C diamante e a dimostrare la struttura tetraedrica del C nel diamante.
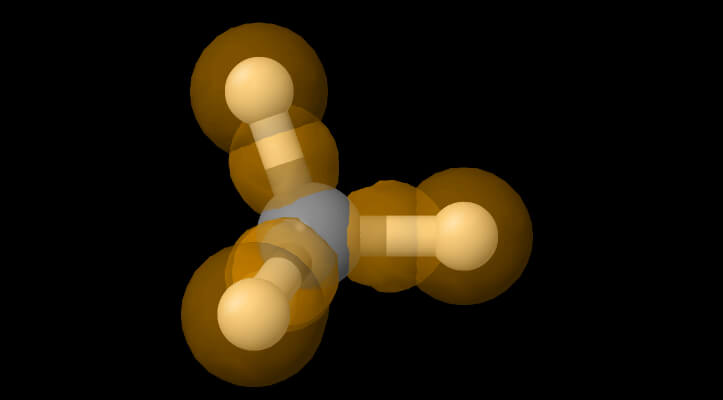
Per spiegare i legami tetraedrici si dovette ricorrere alla formazione di orbitali ibridi derivanti dagli orbitali originari 2s e 2p. Qui illustriamo la struttura del metano alla luce degli orbitali ibridi del Carbonio.
Nella molecola del Metano qui sopra, CH4, i 4 idrogeni si trovano ai vertici di un tetraedro regolare, al cui centro risiede il Carbonio. –
Per spiegare gli angoli e le lunghezze di legame nel CH4, si sono usate delle nuove funzioni orbitaliche, ottenute per ricalcolo a partire dalle funzioni atomiche degli orbitali del guscio di valenza del Carbonio.
Le funzioni d’onda originali 2s e 2p hanno un orientamento diretto lungo i tre assi a 90° l’uno dall’altro. Quindi non spiegano i legami tetraedrici né le lunghezze di legame.
Per questa ragione si considerano delle funzioni che si ottengono per combinazione lineare delle funzioni d’onda originali.
Queste nuove funzioni chiamate ibridi hanno gli angoli di legame opportuni per potersi sovrapporre agli orbitali 1s degli idrogeni.
Questa che segue è invece la struttura del Metano vista secondo gli Orbitali Molecolari che spiegano a pieno le proprietà del metano.
L’orbitale molecolare a più bassa energia
Poi ci sono tre orbitali molecolari degeneri
Poi c’è l’orbitale vuoto LUMO
WIKIPEDIA