L’enzima Malato deidrogenasi, MDH, catalizza reversibilmente l’ossidazione dell’ acido L-malico ad acido ossalacetato.
Esso sfrutta il cofattore NAD+ come ossidante che si trasforma in NADH il quale poi sarà portato nella catena di trasporto di elettroni.

Questo processo lo possiamo ritrovare in molto cicli metabolici tra cui l’acido citrico, nella sintesi di NADPH e nella conversione nel citosol della cellula.
La Malato Deidrogenasi è costitutito da più isoenzimi, enzimi che pur differendo nella sequenza di amminoacidi catalizzano la medesima reazione biochimica.
Nelle cellule eucariote in genere si trovano almeno due forme di MDH, una mitocondriale nell’ultimo stadio del ciclo di Krebs, e l’altra nel citosol per convertire l’acido ossalacetico in acido malico o per lo shuttle malato-aspartato.
Entrambi gli isoenzimi del MDH si trovano nelle condizioni fisiologiche sotto forma di dimeri costitutiti da subunità identiche con due siti attivi uguali. (Nell’animazione di seguito si usa una sola subunità)
Nelle cellule procariote, dove il ciclo di Krebs non avviene nel mitocondrio, possono esserci altri tipi di Malato deidrogenasi dove l’ossidante non è NADH.
Nell’essere umano la MDH è coinvolta nella gluconeogenesi in cui fegato e reni sintetizzano il glucosio a partire da molecole a tre atomi di carbonio, come il Piruvato, per quelle cellule che usano solo il glucosio come fonte di energia.
ADP, fumarato e aspartato.
Termodinamica della conversione da acido Malico a acido ossalacetato.
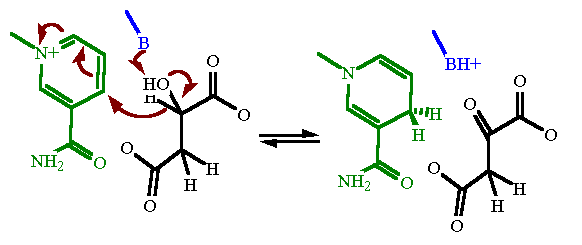
Il processo di ossidazione è un trasferimento di uno ione idruro dal CH2 a NAD+ insieme ad un trasferimento di protone, in modo analogo a quello della LDH, lattato deidrogenasi, che è molto simile alla MDH.
L’energia libera standard biologica per questa reazione è di 29,7kJ/mole mentre nella cellula l’energia libera biologica è circa 0 kJ/mol, quindi reversibile.
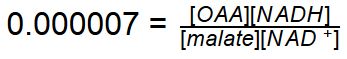
La Kequilibrio per questo processo calcolata sul dato della Energia Libera standard è
Per far procedere la reazione la concentrazione dell’ossalacetato è mantenuta molto bassa dalla Citrato Sintasi che con AcetilCoeA sintetizza l’acido citrico e sposta l’equilibrio verso l’acido ossalacetico.
Struttura della Malato Deidrogenasi
La struttura dell’Acido Malico Deidrogenasi, MDH, è di una unità globulare a sola struttura terziaria formata da 9 alfa eliche e 9 strutture a foglietto.
Le nove alfa eliche formano un piccolo solco dove si lega il cofattore NAD+ vicino alle beta a foglietto. La proteina forma una specie di fessura dove si lega il substrato.
Nella conversione da acido malico ad ossalacetato avviene un cambio conformazionale fondamentale quando si lega il substrato in cui un gruppo di amminoacidi si muove a bloccare il sito attivo. Gli altri residui nel sito attivo sono avvicinnati al substrato per fare la conversione.
A permettere il cambio di conformazione sono due arginine, la 102 e 109.
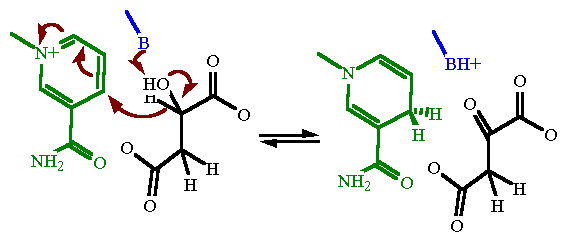
Molecole della trasformazione malato-ossalacetato
– – –
–– – –