I meccanismi di regolazione dei cicli metabolici ed il loro controllo sono modi per regolare, controllare e coordinare l’attività biologica senza avere spreco inutile di massa e di energia.
Le cellule eucariote e procariote hanno differenti meccanismi di regolazione, laddove i microrganismi procarioti sono esposti a molti cambiamenti del loro ambiente fisico e chimico.
Entro certi termini, possono adeguarsi ai cambiamenti attraverso un cambiamento delle proteine strutturali, di trasporto, di un cambiamento di tossine, di enzimi in modo che si possano adattare alla nuova situazione.
 Per esempio l’Escherichia Coli non produce le fimbrie per poter colonnizare un ambiente fintanto che si trova in un ambiente in cui sono sospesi. Il Vibrio cholerae non produce la tossina che causa la diarrea finche’ non si trova nel tratto intestinale umano. Il Bacillus subtilis non produce gli enzimi della sintesi del triptofano se non trova del triptofano preesistente nel suo ambiente.
Per esempio l’Escherichia Coli non produce le fimbrie per poter colonnizare un ambiente fintanto che si trova in un ambiente in cui sono sospesi. Il Vibrio cholerae non produce la tossina che causa la diarrea finche’ non si trova nel tratto intestinale umano. Il Bacillus subtilis non produce gli enzimi della sintesi del triptofano se non trova del triptofano preesistente nel suo ambiente.
Se l’Es Coli viene alimentato in presenza di glucosio e lattosio, usera’ per primo il glucosio poiche’ sono necessari due enzimi in meno quando si nutre col glucosio rispetto a quando usa il lattosio come fonte di C.
La Neisseria gonorrhoeae sviluppa un sistema sofisticato di cattura e trasporto del Fe se si accorge che il Fe e’ pochissimi presente nel suo ambiente.
I batteri hanno sviluppato sofisticati meccanismi di regolazione di cicli catabolici e anabolici.
I batteri in genere non sintetizzano gli enzimi dei cicli catabolici se il substrato di questi enzimi non e’ presente nel loro ambiente. Per fare un esempio, la sintesi degli enzimi che degradano il lattosio diventa uno spreco incredibile se poi il lattosio non si trova nell’ambiente.
In modo analogo i batteri hanno sviluppato diversi meccanismi per il controllo dei cicli anabolici. Le cellule batteriche interrompono i cicli biosintetici quando i prodotti finali dei cicli non sono piu’ necessari o sono prontamente ottenibili dall’ambiente.
Per esempio se un battere puo’trovare un amminoacido gia’ nel proprio ambiente, esempio il triptofano, ha senso interrompere il ciclo metabolico di produzione del triptofano conservando cosi’ molta energia.
Comunque nella vita batterica i meccanismi di controllo per tutti questi cicli deve essere reversibile, poiche’ l’ambiente puo’ cambiare velocemente ed in maniera drastica.
Dal punto di vista termodinamico questi meccanismi permettono la resa più alta possibile
Le condizioni che regolano la formazione degli enzimi
Nelle cellule viventi ci sono centinaia di enzimi diversi che lavorano insieme in modo coordinato. Le cellule viventi non sintetizzano né scompongono più materiale di quanto sia necessario per il normale metabolismo e la crescita.
Tutto ciò richiede precisi meccanismi di controllo per attivare e disattivare le reazioni metaboliche.
Quelli utilizzati dai batteri per regolare la sintesi e l’attività degli enzimi sono estremamente diversi. Praticamente per ogni fase tra l’attivazione di un gene e la reazione enzimatica finale da quel prodotto genico esiste un meccanismo batterico per regolare quella fase. In questa sede esamineremo alcuni esempi ben studiati.
Il controllo genetico dell’attività enzimatica si riferisce al controllo della trascrizione dell’mRNA necessario per la sintesi di un enzima.
Nelle cellule procariotiche, ciò comporta l’induzione, la repressione o il potenziamento della sintesi enzimatica da parte di proteine regolatrici che possono legarsi al DNA e indurre, bloccare o potenziare la funzione dell’RNA polimerasi, l’enzima necessario per la trascrizione.
Le proteine regolatrici fanno spesso parte di un operone o di un regolone. Un operone è un insieme di geni trascritti come messaggio policistronico e controllati collettivamente da una proteina regolatrice.
Un regolatore è un insieme di geni correlati controllati dalla stessa proteina regolatrice ma trascritti come unità monocistroniche. Le proteine regolatrici possono funzionare come repressori, attivatori o esaltatori.
Enzimi costitutivi, inducibili e reprimibili
Come detto in precedenza i procarioti possono cambiare l’insieme dei propri enzimi per adattarsi ad un specifico ambiente. Spesso la concentrazione di un enzima in una cellula dipende dalla presenza del proprio substrato.
Gli enzimi costitutivi sono sempre prodotti dalla cellula indipendentemente dalla composizione del mezzo in cui la cellula si trova. Gli enzimi della Glicolisi e del ciclo di Krebs sono in genere costitutivi e si trovano sempre nel battere alla medesima concentrazione.
Gli enzimi inducibili si producono nelle cellule come risposta ad un particolare substrato e solo quando sono necessari. Nel processo di induzione, il substrato o una molecola ad esso simile evoca la formazione dell’enzima ed e’ talvolta definito come induttore.
Un enzima e’ un enzima reprimibile se la sua sintesi puo’ essere bloccatadalla presenza di un prodotto finale del ciclo a cui l’enzima normalmente partecipa. Il prodotto finale si chiama in questo caso corepressore dell’enzima.
La regolazione delle reazioni enzimatiche
| Colonna 1 | Livello del metabolismo | Controllo del metabolismo | Esempio |
| DNA | Struttura del DNA/td> | Pochi agiscono cambiando la struttura di un gene | Variazione di fase |
| DNA | trascrizione | Controllo dell’espressione del gene agisce sulla frequenza di trascrizione | induzione e repressione |
| mRNA | traduzione | La concentrazione di certe proteine viene stabilito modulando la traduzione | Proteine che fanno parte dei ribosomi dove avviene la sintesi proteica |
| Proteine | Modifiche posttraduzione | La funzione proteica e’ controllata modificandola dopo la sua sintesi | Reazione di attracco di una adenosimonofosfato ad un residuo per bloccare la sua attivita’ enzimatica |
| Pro Allosteriche | Attivatori e disattivatori alloesterici | L’attivita’ della proteina viene modificata per la presenza di modificatori allosterici nel sito attivo | Fosfofruttochinasi, piruvatodercarbossilasi … |
Alcuni composti sono necessari in larga quantita’ altri invece no, per cui alcune reazioni corrsipettive devono avvenire finche’ non si e’ prodotta la quantita’ richiesta di sostanza.
Nelle cellule batteriche le reazioni enzimatiche possono essere regolate da due modi indipendenti:
1. controllo e regolazione dell’attivita’ dell’enzima (inibizione da feedback o inibizione da prodotto finale) che in genere funziona per regolare i meccanismi di biosintesi;
2. controllo o regolazione della sintesi dell’enzima includendo repressione da prodotto finale (che funziona nella regolazione dei cicli anabolici) ed induzione dell’enzima e repressione da catabolita (essenzialmente nei cicli catabolici)
L’inibizione da feedback regola l’attività di enzimi preesistenti nella cellula. I processi di repressione da prodotto finale, di induzione di enzima e di repressione da catabolita sono coinvolti nel processo di sintesi dell’enzima e possono essere una forma di controllo positivo o negativo.
La repressione da prodotto finale e l’induzione dell’enzima sono un controllo negativo che portano ad un decremento nella trascrizione delle proteine. La repressione da catabolita e’ considerata una forma positiva poiche’ produce un aumento nella trascrizione delle proteine.
Le Proteine allosteriche
Benche’ ci siano vari punti di controllo in un processo di regolazione come si evince dalla tabella di sopra, i piu’ comuni sono a livello di trascrizione e a livello di modifica dell’attivita’ delle proteine preesistenti.
A loro volta questi punti di controllo sono modulati da proteine e/o enzimi che hanno la proprieta’ di essere molecole allosteriche.
Per una dettagliata trattazione di questo argomento si vada al link sulle molecole allosteriche.
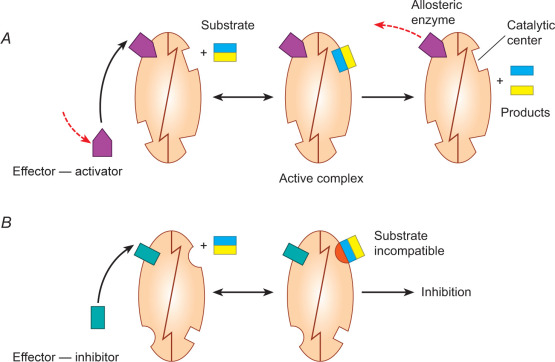
In una molecola o enzima allosterico sono presenti almeno un sito catalitico ed un sito allosterico. Il primo lega il substrato, il secondo lega alcune molecole (effettori) che possono o reprimere o esaltare l’attivita’ di questa proteina o enzima attraverso una modificazione della conformazione della proteina stessa.
In un enzima allosterico, il sito attivo si lega al substrato dell’enzima e lo converte in un prodotto. Il sito allosterico è occupato da una piccola molecola che non è un substrato. Tuttavia, quando il sito allosterico viene occupato dalla molecola effettrice, la configurazione del sito attivo viene modificata in modo tale da renderlo incapace di riconoscere e legarsi al suo substrato.
Se la proteina è un enzima, quando il sito allosterico è occupato, l’enzima è inattivo, cioè la molecola effettrice diminuisce l’attività dell’enzima. Esiste tuttavia una situazione alternativa. La molecola effettrice di alcuni enzimi allosterici si lega al suo sito allosterico e di conseguenza trasforma l’enzima da uno stato inattivo a uno attivo.
Alcuni enzimi allosterici multicomponente hanno diversi siti occupati da varie molecole effettrici che modulano l’attività dell’enzima in una serie di condizioni.