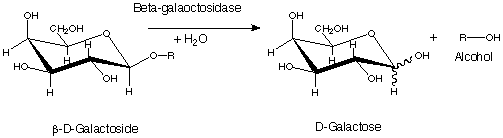
La β-galattosidasi, anche nota come Lattasi, è una idrolasi glicosidica che catalizza l’idrolisi dei residui terminali non riducenti del β-D-galattosio nei β-D-galattosidi
Tra i substrati della lattasi c’è il lattosio oltre a varie glicoproteine che contengono di β-D-galattosio.
La Lattasi è una esoglicosidasi che idrolizza il legame β-glicosidico tra il galattosio e la struttura organica.
Nell’Escherichia Coli è codificato dal gene LacZ che fa parte del sistema inducibile dell’Operone Lattosio, o Lac Operon, che è attivato in presenza di lattosio finché il glucosio è poco.
Dal punto di vista industriale questo enzima permette la produzione di prodotti caseari liberi da lattosio utilizzati da chi è intollerante al lattosio.
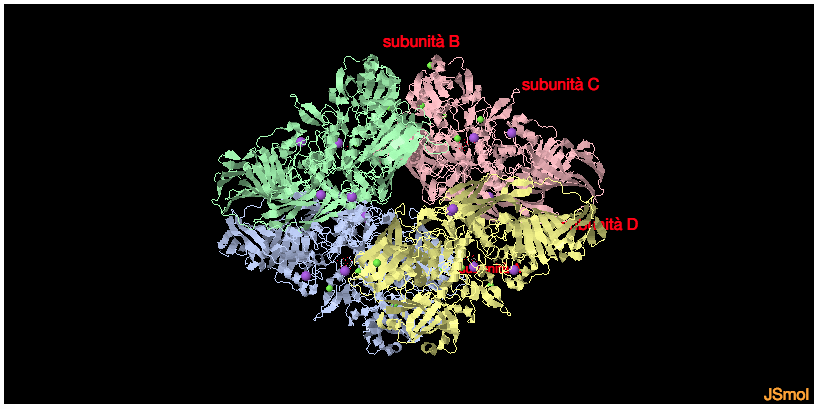
La β-galattosidasi del E.COli è una proteina formata da 1023 amminoacidi e forma un omotetramero, quattro unità dello stesso monomero, dal peso di 464 kDa, dove ogni unità consiste di 5 DOMINI.
Molto importanti sono gli Ioni Na+ o K+ e gli ioni bivalenti Mg2+ oppure Mn2+. I cationi come Na+ e K+ modificano l’affinità dei substrati, gli stati di transizione delle reazioni e la stabilità degli intermedi.
Ci sono sei atomi di Mg2+ ma solo due influenzano direttamente l’attività e sono quelli che si legano vicino al sito di legame del substrato
La β-Galattosidasi catalizza tre reazioni nella cellula.
In una reazione di transglicosilazione, fa la sintesi dell’Allolattosio, dove il legale glicosidico è β-O-1-6 e non β-O-1-4 come nell’isomaltosio.
L’allolattosio, che si forma al 50% insieme ai prodotti di idrolisi, è importante perché è la molecola che permette l’attivazione dell’ Operone Lattosio e la sintesi della Galattosidasi.
Questo è un caso di ciclo di feedback positivo.
La seconda reazione è l’idrolisi del Lattosio in glucosio e galattosio, mentre la terza è l’idrolisi stessa dell’allolattosio.
La β-galattosidasi la si può ritrovare in molte piante e frutti, mammiferi, lieviti, batteri e funghi con differenze però nella lunghezza di sequenza codificante e di proteine che la formano. Si hanno perciò quattro famiglie: GHF-1, GHF-2, GHF-35, and GHF- 42.
Quella dell’E.Coli appartiene alla GHF-2, mentre quelle delle piante alla GHF-35 e quella del Thermus Thermophilus al GHF-42, che è l’altra struttura conosciuta e studiata nei dettagli, forse perché proveniente da un microrganismo termofilo.
Nella frutta e nei pomodori sono presenti differenti tipi di galattosidasi che giocano un ruolo nell’ammorbidimento e maturazione della frutta. Nella pesca per esempio sono stati trovati 17 geni diversi di codifica della β-galattosidasi.
Galattosidasi nelle produzioni di prodotti alimentari
La β-Galattosidasi o lattasi è anche usata in ambito industriale per produrre prodotti caseari ed ogni microrganismo produce lattasi con caratteristiche particolari.
Quella dell’Aspergillus Niger ha un pH ottimale tra 3 e 5 e temperature ottimali tra 55-60°C, mentre quella del Kluyveromyces fragilis e Kluyveromyces lactis hanno il pH ottimale a pH neutri.
Per temperatura ottimale si intende il campo di temperature a cui l’attività di un dato enzima è massima, oltredecr la quale cominciano i processi di denaturazione delle proteine.
Alle temperature minori del punto ottimale l’attività enzimatica decresce con la temperatura secondo le leggi della cinetica chimica della costante di Arrenhius.
La temperatura ottimale di un enzima dipende dal microrganismo che lo produce, se termofilo, mesofilo, o psicrofilo.
Il problema è che queste lattasi hanno una cattiva stabilità a temperature anche di 48 °C, per cui l’attenzione si è spostata sui batteri lattici termofili che sono anche sicuri sul piano sanitario (GRAS).
Tra questi ci sono i batteri dello Yogurt Lactobacillus bulgaricus and Streptococcus thermophilus che sono i migliori produttori di questa proteina caratterizzata da grande stabilità e attività anche a temperature abbastanza alte. In queste condizioni si migliora la velocità di idrolisi e si previene la crescita di batteri indesiderati.
Le lattasi sono utilizzate principalmente per migliorare le caratteristiche tecnologiche e sensoriali degli alimenti con l’aumento della solubilità degli zuccheri, la formazione di galatto-oligosaccaridi, la riduzione del contenuto di lattosio (per gli alimenti lattiero-caseari destinati agli intolleranti al lattosio) e la conversione del siero di formaggio in diversi prodotti a valore aggiunto.
Alcuni elementi strutturali della Beta Glucosidasi
Il sito attivo si trova nel DOMINIO 3 ed è costituito da da due subunità del tetramero. Si è visto nei primi studi che la rimozione di alcuni residui vicino all’estremità N terminale (23-31 o 11-41) causava la perdita di attività per dissociazione in dimeri inattivi.
— — – —