Dopo aver visto le varie parti della Cinetica Enzimatica, qui presentiamo l’ effetto del pH sull’attività enzimatica che afferisce sia la sua stabilità che la sua capacità catalitica
Gli enzimi sono molecole anfotere che contengono un gran numero di gruppi acidi e basici, posti in genere sulla sua superficie, la cui carica varia, secondo le loro costanti di dissociazione, in base al pH dell’ambiente. (tavola sotto)
La loro carica influenzerà la carica totale netta sugli enzimi e la distribuzione delle cariche sulla superficie esterna oltre ad influenzare la reattività dei loro grupppi attivi cataliticamente.
Questi effetti sono particolarmente importanti nelle vicinanze del sito attivo ed essi influenzano col cambiamento del pH l’attività dell’enzima, la sua stabilità strutturale e la solubilità dell’enzima.
| Gruppo | Campo della pKa | Carica approssimata a pH7 | Calore di ionizzazione |
|---|---|---|---|
| Acido glutammico e aspartico terminali | 3-6 | -1 | 5 Kjal/mole |
| Ammonio terminale (lisina) |
7:9 9:11 |
+1 | +45 Kj/mole |
| Istidina | 5-8 | +0,5 | +30 Kj/mole |
| Arginina | 11-13 | +1 | 50 Kjal/mole |
| Tirosina | 9 – 12 | 0 | +25 Kj/mole |
| Cisteina | 8 – 11 | 0 | +25 Kj/mole |
Ogni enzima ha un suo pH caratteristico a cui la carica netta sulla molecola è NULLA e questo pH è chiamato pI, o punto isoelettrico, a cui in genere l’enzima ha una solubilità minima in soluzione acquosa.
In modo simile all’effetto sull’enzima, i cambiamenti di pH influenzeranno la carica e la distribuzione della carica sui substrati, sui prodotti e coenzimi.
Se si accresce la [H+] si accresce la competizione degli ioni idrogeno verso i siti di legame di metalli sull’enzima, riducendo la concentrazione del metallo legato.
D’altro canto se invece si decresce la [H+] si accresce la [OH-] che competono contro i leganti dell’enzima per i cationi di e trivalenti causando la loro conversione in idrossidi e la loro rimozione completa dall’enzima ad alte concentrazioni di OH-.
La temperatura ha anche un marcato effetto sulle ionizzazioni che dipendono dai calori di ionizzazione dei particolari gruppi (vedi tabella di su)
La variazione tra cambio del pKa e cambio di temperatura è data da una derivata dell’equazione di Gibbs-Helmotz
![]()
dove T è la temperatura assoluta in Kelvin, R è la costante dei gas ideali (8.314 J M−1 K−1), DH è il calore di ionizzazione. Questa variazione è sufficiente a spostare il pI, punto isoelettrico, degli enzimi fino ad una unità più bassa di pH con un aumento di 50 gradi di temperatura.
Queste variazioni di carica, oltre alle alterazioni strutturali conseguenti, si possono riflettere in cambiamenti nel legare il substrato, nell’efficienza catalitica e nella quantità di enzima attivo.
Saranno alterati sia Vmax che Km a causa delle modifiche risultanti delle costanti di velocità cinetiche k+1, k-1 e kcat (K+2 nel meccanismo della Michaelis Menten) e nella variazione di concentrazione dell’enzima attivo.
L’effetto del pH sulla Vmax di una reazione enzimatica la si può spiegare usando l’assunzione generalmente vera che solo una forma carica dell’enzima è catalitica in modo ottimale e perciò la concentrazione massima dell’intermedio enzima-substrato non può essere maggiore della concentrazione di queste specie. Si assume che la forma E- sia la sola forma attiva dell’enzima.
![]() [1.8]
[1.8]
The concentration of EH− is determined by the two dissociations
![]() [1.9]
[1.9]
![]() [1.10]
[1.10]
con
![]() [1.13]
[1.13]![]() [1.14]
[1.14]
Poi
![]()
Quindi
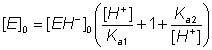
Poiché la velocità di reazione è data da k+2[EH−S] e questa è massima quando [EH−S] is massimo (i.e., quando [EH−S] = [EH−]0):
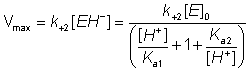
La Vmax sarà massima quando
![]()
Perciò
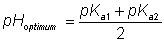
Questa derivazione ha fatto varie semplificazioni sulla situazione reale. Ignora gli effetti di ionizzazione sui substrati, prodotti e complessi enzima substrati ed assume che E- sia una specie ionizzata singola, laddove potrebbe contenere una miscela di gruppi ionizzati in modo differente ma con identica carica complessiva, sebbene il processo di legare il substrato tenda a fissare le specie ioniche richieste.
Comunque produce una variazione di velocità massime col pH che dà la curva comunemente incontrata della forma a campana.Figure 1.4.
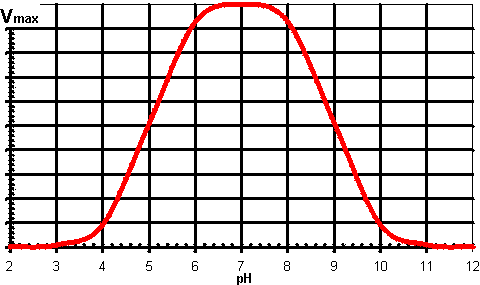
Un diagramma schematico applicabile della variazione della Vmax di un enzima con il pH della soluzione. Il pH ottimale e la larghezza di questa curva a campana dipendono dalle costante di dissociazioni degli acidi dei gruppi importanti dell’enzima. Si deve notare che alcuni enzimi mostrano poca somiglianza a questa curva.
Laddove lo schema di reazione è più complesso, ci potrebbe essere una reazione più complessa tra Vmax e pH. Ci potrebbe essere in particolare un cambio nello stadio determinante della velocità con il pH.
Si deve riconoscere che la Km può cambiare col pH in un modo indipendente dalla Vmax dal momento che coinvolge altri gruppi ionizzabili. E’ chiaro che a concentrazioni di substrato non saturanti i cambi di attività col pH potrebbero anche non riflettere i cambi nella Vmax.
Si deve notare anche che dalla discussione precedente che la variazione di attività con il pH dipende dalla direzione della reazione in considerazione. il PH ottimale potrebbe non essere lo stesso per la direzione diretta ed inversa. Il che è particolarmente notevole in reazioni che liberano o utilizzano protoni (le deidrogenasi) dove potrebbe essere differente di 2 unità il pH ottimale per la reazione diretta ed inversa.
Variazioni di attività col pH all’interno di due o tre unità di pI è un processo reversibili, ma variazioni estreme di pH causeranno un processo di denaturazione dipendente dal tempo e dalla temperatura di tipo irreversibile.
In soluzioni a pH>8, ci potrebbe essere la distruzione dei residui di cistina, mentre a pH<4 si potrebbe avere l'idrolisi dei legami peptidici vicini all'acido aspartico.
Comunque in molti processi industriali coinvolgenti enzimi vari fattori possono far sì che il pH di lavoro non sia quello ottimale della curva.
Questi possono essere variazioni di solubilità del substrato e del prodotto, cambiamenti nella posizione di equilibrio della reazione, soppressione della ionizzazione di un prodotto per facilitare la sua ripartizione e assorbimento in una fase organica, la riduzione nella suscettibilità alll'ossidazione o alla contaminazione microbica.
L'effetto maggiore è l'effetto del pH sulla stabilità dell'enzima, relazione complicata ancora dalla variazione nell'effetto del pH con la durata del processo e la temperatura.
Il parametro importante derivato da queste influenze è la produttività dell'enzima, cioè quanto substrato si può convertire a prodotto.
Inibizione