Inibizione Competitiva può essere di due tipi a seconda della posizione a cui si lega l’inibitore: sito attivo o sito allosterico
Inibizione competitiva per formazione di legami col sito attivo
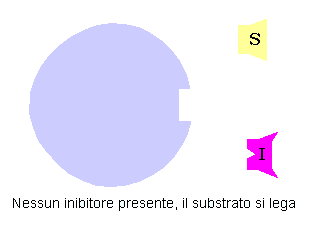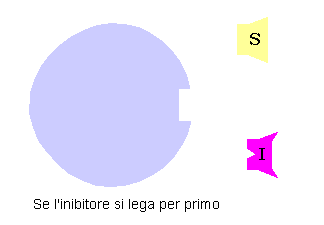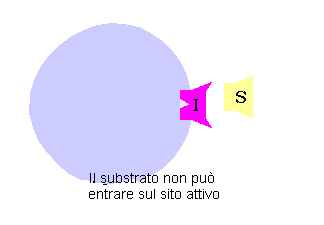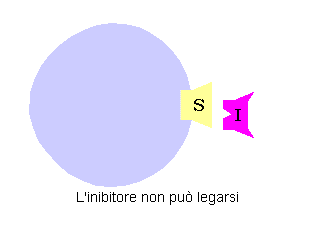
Da un punto di vista classico un inibitore competitivo è un composto che ha una stretta somiglianza strutturale e chimica col substrato. Questa somiglianza lo fa legare al sito attivo al posto del substrato. Comunque dal momento che inibitore e substrato non sono la stessa molecola non si ha la trasformazione dell’inibitore in un prodotto, ma esso resterà legato al sito attivo.
Finché l’inibitore bloccherà la strada al substrato, non si potrà avere la trasformazione nel substrato. In modo simile se è il substrato a legarsi prima, l’inibitore non potrà funzionare. Si dice che i due sono mutualmente escludenti, in quanto non possono legarsi assieme all’enzima.
Inibizione competitiva per cambiamento di conformazione
Il sistema descritto sopra è tra i più comuni modi di funzionamento dell’inibizione competitiva. Un altro sistema è che l’inibitore non si lega al sito attivo ma in un’altra zona dell’enzima tipica per quell’inibitore, che è localizzata in una porzione diversissima dell’enzima stesso. Quando l’inibitore si lega causa un cambiamento della forma tridimensionale dell’enzima che ha come conseguenza una modificazione del sito attivo e la conseguente impossibilità per il substrato di legarsi ad esso.
Se a legarsi prima è invece il substrato, si ha che la configurazione dell’enzima si modifica impedendo l’entrata dell’inibitore sul sito suo caratteristico.

Ancora una volta non è possibile ad inibitore e substrato di legarsi insieme e sono ancora mutuamente escludenti.
In questa inibizione non c’è nessun bisogno di una somiglianza chimica tra inibitore e substrato dal momento che si legano a siti differenti dell’enzima.
Ovviamente questi due meccanismi hanno dei riflessi sulla cinetica dei processi enzimatici, la cui natura ci permette di differenziare fra i vari tipi di inibizione.
Cinetica degli inibitori Competitivi
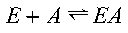
In presenza di un inibitore competitivo l’enzima può legarsi al substrato secondo questa reazione per formare un complesso enzima substrato
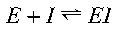
oppure l’inibitore può dare un complesso enzima inibitore secondo questo equilibrio:
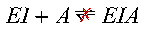
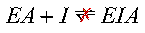
La formazione di un complesso ternario in cui siano legati insieme enzima, substrato ed inibitore non è possibile, in quanto sono mutualmente escludenti
Entrambe queste reazioni sono veloci e reversibili dando perciò luogo ad equilibri, la cui posizione dipenderà naturalmente dalla concentrazione dei reagenti. Inoltre i due equilibri hanno in comune l’enzima e perciò saranno dipendenti l’un dall’altro.
Di conseguenza ad alta concentrazione di inibitore tutto l’enzima si troverà sotto forma di EI e l’enzima sarà del tutto o quasi inibito in quanto non resterà enzima libero per attaccare il substrato. D’altra parte ad alte concentrazioni di substrato quasi tutto l’enzima sarà convertito in EA e non resterà enzia per reagire con l’inibitore.
Per questa ragione gli inibitori competitivi perdono la loro forza inibente ad alte concentrazioni di substrato.
Si dice che essi sono allontanati dal sistema per competizione.
Quale sarà l’effetto sui parametri cinetici?
Effetto su Km
Km è un’indicazione dell’affinità enzima substrato. In presenza di inibitori competitivi alcune molecole di enzima saranno ancora libere, altre complessate. Le prime avranno la stessa affinità per il substrato, le altre avranno affinità nulla per il substrato essendo incapaci di legare il substrato. Km è una misura complessiva della affinità dell’enzima nella miscela di reazione che sarà perciò un valore mediano tra l’affinità nulla del complesso EI e quella massima di E.
Un inibitore competitivo ridurrà l’affinità enzima substrato, cioè aumenterà il valore di Km.
Effetto su Vmax
Vmax è la velocità di reazione ad alte concentrazioni di substrato. In queste condizioni l’inibitore è stato spostato dal substrato e perciò non inibisce più l’enzima. Ad alte concentrazioni di substrato la reazione non viene rallentata e Vmax deve essere sempre lo stesso.
La curva della MM nel caso di un inibitore competitivo e senza inibizione sarà
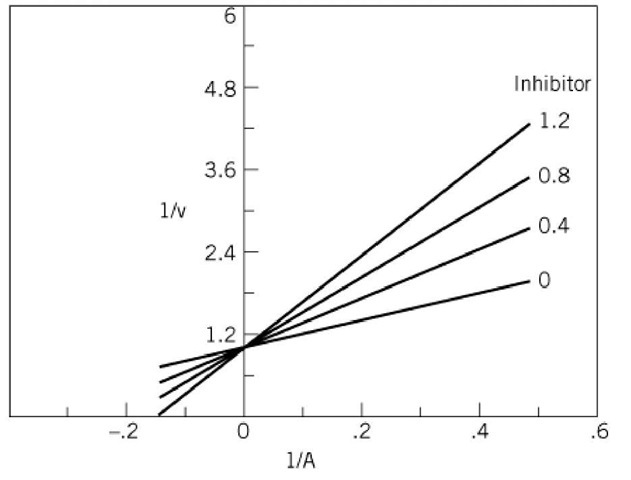
Grafico Lineweaver-Burk
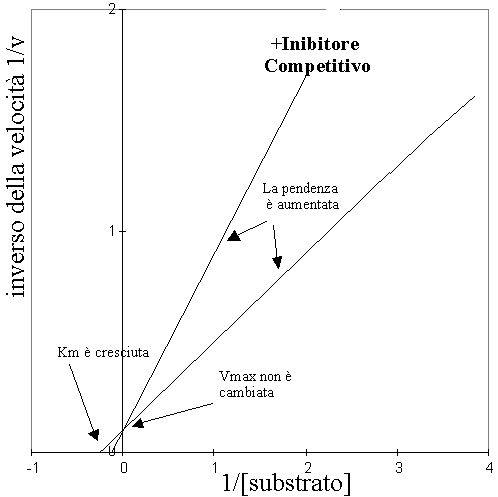
I risultati sono messi in un grafico Lineweaver-Burk. La pendenza della retta dei doppi reciproci è data da Km/Vmax.
Un aumento della pendenza della curva dovuto all’aumento di Km e costanza di Vmax indica perciò una riduzione nella velocità di reazione a basi livelli di substrato.
Aumentando la concentrazione di I inibitore, aumenta la pendenza della retta.
Gli inibitori competitivi impediscono al substrato di legarsi al substrato e formare il prodotto. Poiché sono mutualmente esclusivi, se il substrato si lega prima impedisce l’inibizione e ad alte concentrazioni di substrato l’inibizione è impedita cosicché la Vmax non viene cambiata dalla loro presenza.
Perciò la loro attività si esplica a basse concentrazioni di substrato con una conseguente crescita intesa come valore medio nell’ambiente di reazione.misurata da Km. Questo effetto si manifesta sia che l’inibitore si lega al sito attivo sia che si leghi in un sito suo particolare modificando la struttura dell’enzima stesso.
Esempi di inibitori competitivi son abbondanti nel campo dei medicinali come per la Relenza che inibisce competitivamente le neuramidasi virali del virus dell’influenza.
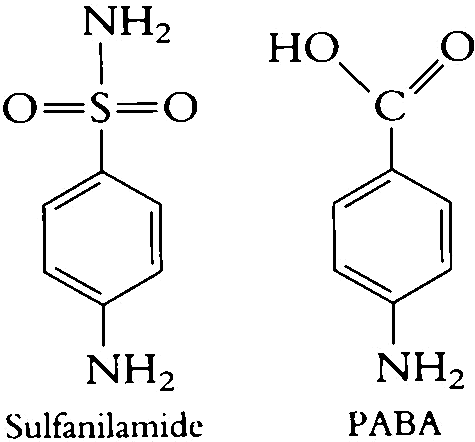
Un altro esempio di inibitore competitivo sono i sulfamidici che inibiscono la sintesi dell’acido folico perché molto simile nella struttura al PABA, p-amminobenzene,