Nella glucolisi l’aldolasi rompe il fruttosio bifosfato in due molecole da tre atomi di C, mentre nella gluconeogenesi fa esattamente il processo opposto.
Nella glicolisi si ha il processo scritto sotto con un guadagno netto di due ATP/glucosio.
Glucosio + 2 NAD+ + 2 ADP + 2 Pi –> 2 piruvato + 2 NADH + 2 ATP + 2 H20 + 4 H+
La gluconeogenesi serve a mantenere il contenuto di glucosio costante sintetizzandolo da precursori non carboidrati, come acido lattico, piruvato, intermedi del ciclo di Krebs, amminoacidi.
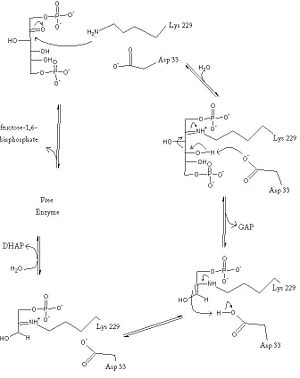
Nello specifico l’enzima aldolasi catalizza la rottura del Fruttosio 1-6 difosfato in diidrossiacedone fosfato DHAP e gliceraldeide fosfato GAP.
Esistono comunque altre aldolasi che hanno differenti substrati. Tutti però hanno come compito di condurre una condensazione aldolica oppure la sua reazione inversa.
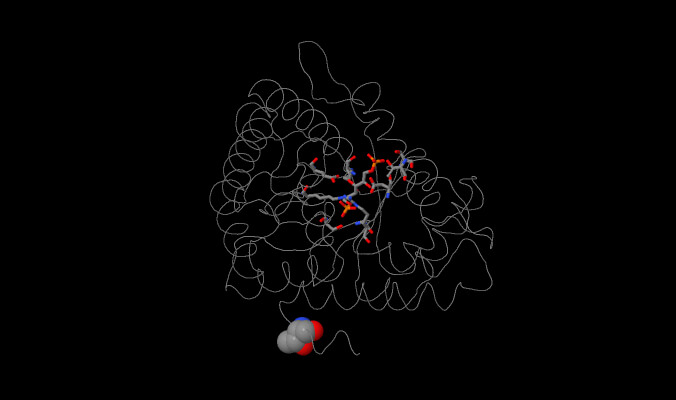
Struttura del Fruttosio 1-6 difosfato aldolasi.
L’enzima si trova sotto forma di OMOTETRAMERO anche se è possibile trovarlo come monomero. Non mostra alcuna cooperatività positiva ma una cooperatività negativa. Questo comporta che all’interno di ogni singola subunità la catalisi è molto compartimentalizzata ed il legarsi del substrato non causa perciò modificazioni alla struttura dell’enzima.
E’ formato da nove strutture alfaelica ed otto beta a pieghe parallele in una subunità a barile chiusa per ogni monomero.
Amminoacidi del sito attivo dell’aldolasi che tengono il fosfato del C1 sono GLY 294, SER 264 e ARG 295, mentre SER 25, ASP23 e TYR28 tengono legato il Fosfato del C6.
Lì vicino c’è Lis223 che porta il gruppo NH2 per fare la base di SCHIFF ed GLU 178 che assiste l’uscita degli H+ ed Acqua.
Se si cambia la Tyr335 con altro amminoacido si nota una caduta di attività di tutto l’enzima.
La catalisi inizia con la formazione di una Base di Schiff tra il Carbonile del FBP in conformazione aperta con il gruppo amminico del LYS223. Successivamente si ha la rottura del legame C3-C4 grazie anche alla stabilizzazione elettrostatica del GLU178.
La regolazione dell’aldolasi sembra avvenire attraverso l’espressione del gene con la concentrazione del mRNA nel citoplasma e l’ossidazione del tiolo della CIS72.
(file originale Proteopedia)
Reagente di partenza nella forma APERTA e
nella forma SEMIACETALICA
Prodotti che si formano nella glicolisi per effetto dell’aldolasi
–
–
ALDOLASI
—