L’etilene, il cui nome IUPAC è in Etene, è la molecola più semplice della classe degli alcheni.
Questi sono idrocarburi insaturi che presentano almeno un doppio legame C-C e sono anche chiamati Olefine.
L’etilene ha una formula bruta del tipo C2H4, come tutti gli alcheni la cui formula bruta è CnH2n, al contrario degli Alcani la cui formula è CnH2n+2
A causa dell’insaturazione presente, l’etilene e gli alcheni sono più reattivi degli alcani e presentano reazioni di addizione di reagenti elettrofili, di idrogeno molecolare in presenza di catalizzatori ed altre reazioni. Rappresentano inoltre i primi composti usabili per sintetizzare molecole più complesse.
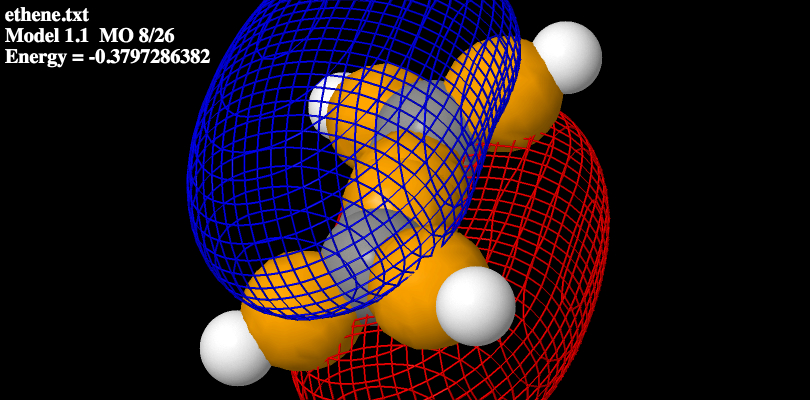
La molecola dell’Etene può essere spiegata con la teoria degli orbitali ibridi
Secondo questa teoria i due C sono ibridizzati sp2 e sono legati, oltre che l’un l’altro, anche a due idrogeni.
Questi legami tra gli sp2 del C e due orbitali 1s degli U e un sp2 dell’altro C hanno una simmetria SIGMA.
Perpendicolarmente al piano degli atomi i due orbitali 2pz, lasciati disponibili dall’ibridazione, possono sovrapporsi lateralmente secondo una simmetria Pgreca.
L’angolo di legame H-C-H è 117°, molto vicino all’angolo ideale di 120°. L’altroo angolo di legame (H-C=C) è 121.5°.
A causa della presenza di un doppio legame C=C, si perde la libera rotazione del legame che è tipica degli alcani e cicloalcani rendendo possibile la nascita della isomeria geometrica cis-trans o E-Z che hanno una differente stabilità termodinamica valutata dal calore di idrogenazione.

Nella struttura dell’etilene e degli altri alcheni mostrati giù si mostrano gli orbitali molecolari di frontiera dell’alchene, HOMO e LUMO, la mappa di superficie di Van Der Walls, e la mappa di separazione di carica, MEP.
La MEP ci dice dove si trova la densità elettronica e definisce i centri positivi e negativi della molecola.
Gli orbitali LUMO sono gli orbitali molecolari non occupati a più bassa energia; mentre HOMO sono gli orbitali molecolari occupati a più alta energia.
Dati Termodinamici
– – –––
––––
––––
––––