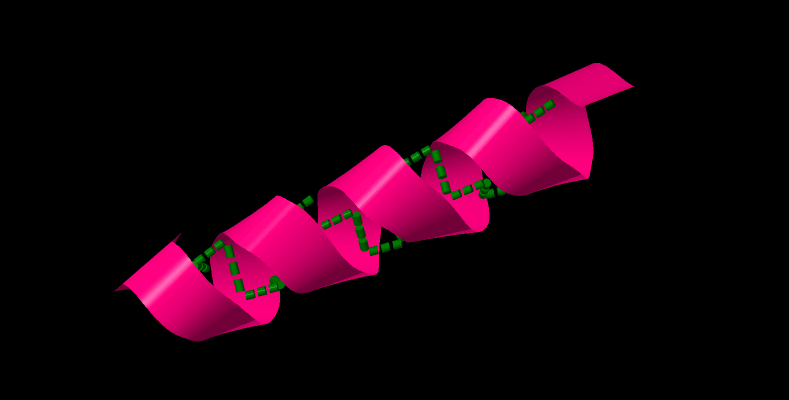
La prima delle strutture secondarie delle proteine analizzata è chiamata alfa elica oppure elica destrosa
Questa struttura più presente nelle proteine, che si forma in seguito a dei parametri degli angoli di psi e phi ben particolari.
Quando una sequenza di amminoacidi ha degli angoli di phi attorno a -60, e psi compresi tra -45e -50 (rivedere il diagramma di Ramachandran), la struttura che risulta è una alfa elica destrosa.
Ogni giro dell’elica attorno all’asse dell’elica è costituito di 3.6 amminoacidi, e l’elica avanza di 5.4 Angstrom, che rappresenta il passo. La causa di questa organizzazione è la formazione dei legami ad Idrogeno, all’interno della catena, tra l’H legato ad un gruppo carbonile del legame ammidico di un amminoacido e l’Ossigeno del carbonile di un altro amminoacido distante quattro amminoacidi, tra l’amminoacido alla posizione i e quello alla i+4.
Il legame N-H e il Legame C=O sono ovviamente allineati e puntano l’uno verso l’altro. Il carbonile punta verso l’estremità C terminale, NH verso l’estremità N terminale.
Va notato che i residui, cioè le catene laterali degli amminoacidi puntano tutti verso l’esterno dell’elica per rendere minime le interazioni e le repulsioni tra loro.
Alfa elica ideale. Questa visualizzazione è quella tipica detta, che dà un’idea dell’elica destrosa stessa. Visualizziamo ora la stessa elica. Si ruoti la molecola fino a visualizzarla lungo l’asse stesso dell’elica. Si noerà come tutte le catene laterali degli amminoacidi sono radiali rispetto all’asse dell’elica, abbassando così le energie di repulsione sterica dei residui. Si nascondano le catene lateraliper visualizzare come l’interno dell’elica sia vuoto ed il legame ad idrogeno tra i residui.Col mouse si selezionino gli atomi del legame ad H e si notino le posizioni degli amminoacidi nella catena.