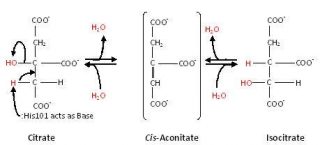
L’Aconitasi è un enzima che catalizza l’equilibrio chimico da citrato a L isocitrato nel ciclo di Krebs passando attraverso un intermedio, il cisaconitato.
citrato = aconitato + H2O = L(-)isocitrate
Le aconitasi possono trovarsi nel citoplasma delle cellule oppure nei mitocondri.
Le aconitasi citoplasmatiche sono bifunzionali: catalizzano sia la conversione da citrato ad isocitrato, ma agiscono anche come proteine regolatrici del Ferro.
Sono proteine monomeriche con 750 residui circa.
Nella maggior parte degli organismi è un enzima che si trova nel citosol con un dominio ACO, e negli eucarioti una seconda copia è stata introdotta nei mitocondri, mAc. Le piante hanno sviluppato più copie nei mitocondri.
Il nocciolo reattivo di questo enzima è un cluster di Ferro e Zolfo, Fe4S4 che si converte a Fe3S4 quando l’enzima è inattivo.
Il meccanismo catalitico dell’Aconitasi mitocondriale
La forma inattiva della aconitasi contiene il cluster (3Fe-4S) che è tenuto insieme da tre atomi di zolfo di tre cisteine: 385,448 e 451 legati ai tre atomi di Ferro.
Con l’attivazione dell’enzima entra un quarto atomo di ferro nel cluster insieme ad una molecola di acqua. Questo Fe4 è libero di legare uno, due o tre partner e gli Osssigeni appartengono sempre ad altre molecole.
Per tutti i passaggi del meccanismo si veda l’articolo originale su Proteopedia
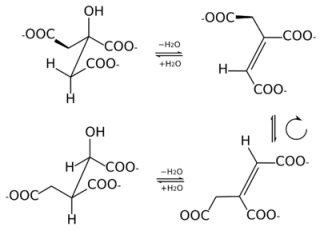 Quindi la reazione complessiva che l’aconitasi catalizza è: Citrato ←→cis-Aconitato ←→ Isocitrato, come si può vedere qui.
Quindi la reazione complessiva che l’aconitasi catalizza è: Citrato ←→cis-Aconitato ←→ Isocitrato, come si può vedere qui.
Regolazione della Aconitasi
L’enzima può essere inibito o attivato per accrescere o decrescere l’abilità a catalizzare la reazione da citrato a isocitrato. L’attività dell’aconitasi si riduce quando un Ferro si perde dal cluster.
Il ciclo dell’acido citrico, conosciuto anche come ciclo di Krebs, lavora in modo che il prodotto di una reazione diventa il reagente del successivo catalizzato da un altro enzima. Alcuni di questi enzimi sono regolati strettamente, o attivati o inibiti dalla concentrazione dei reagenti, prodotti o ATP o NADH e quindi determinanti.
L’aconitasi non è uno di questi enzimi determinanti del ciclo di Krebs poiché la sua energia libera non è negativa (ΔG°′≈5 kJ/mol and ΔG≈0 kJ/mol).
L’aconitasi funziona quasi all’equilibrio ed il tasso di consumo del citrato dipende dall’attività dalla isocitrato deidroidrogenasi NAD+ dipendente che è uno dei tre enzimi che determinano il ciclo di Krebs.
Questo enzima usa l’isocitrato della aconitasi ed è inibito come la citrato sintasi dal NADH, ma la aconitasi non lo è.
La velocità dell’aconitasi dipende dalla attività dell’isocitrato idrogenasi e quindi si potrebbe avere un accumulo di citrato che inibirebbe a sua volta la citrato sintasi.
Questo è un modo di lavorare del ciclo di Krebs per produrre ATP senza disperdere risorse. Inibizioni attivazioni di enzimi avvengono anche a econda la concentrazione di ATP, NADH, Calcio e CoenzimaA.
Aconitasi citosolica e altre funzioni
Nei mammiferi si è sviluppata una seconda funzione come inibitore di quel mRNA che trasporta un elemento che risponde al Fe, IRE. Per questo l’aconitasi citosolica è anche detta IREBP per la proteina che lega IRE quando si parla di questa funzione.
A seconda della presenza del cofattore cluster (4Fe-4S) solo una delle funzioni è attiva: il cluster è essenziale per il funzionamento della aconitasi.
Si veda come cambia la proteina in assenza del cluster ferro Zolfo.
L’aconitasi fa parte della famiglia di proteine regolatori del ferro IRP-1 che giocano un ruolo regolatore nelle proteine che legano il RNA. Questo suggerisce un nuovo ruolo per interruttori di regolazione postraduzione. Link Originale di riferimento
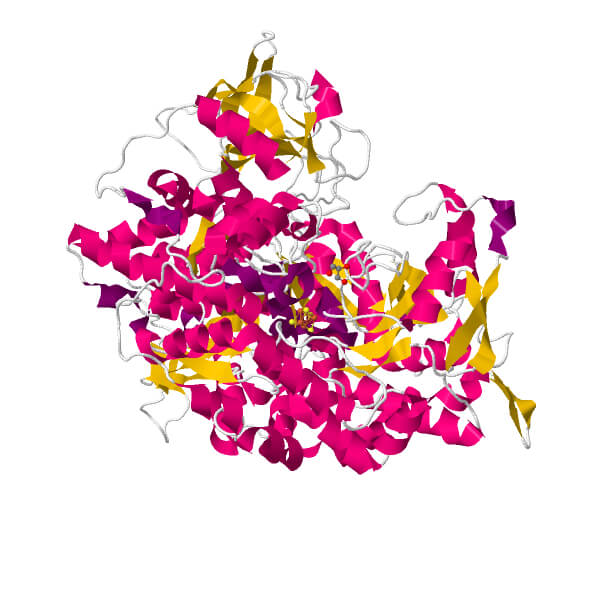
LA STRUTTURA DELLA ACONITASI nella forma inattiva
La struttura secondaria consiste di numerose alfa elica e beta a pieghe alternate a formare una struttura terziaria a due lobi al cui centro vi è un cluster di Ferro Zolfo, 4Fe4S. Non ha una struttura quaternaria. Esaminiamo i domini presenti.
Il resto del sito attivo è costituito dai residui del