La lattoferrina controlla il rilascio del Ferro alle cellule e controlla il livello di Ferro nel Sangue e nelle secrezioni.

Essa ha una affinità per il Ferro di circa 300 volte maggiore delle altre transferine.
Come tutte le altre transferine ha una massa di 80kDa ed è formata da circa 700 amminoacidi ed essa è una glicoproteina. La concentrazione maggiore di lattoferrina o lattotransferrina la si ritrova nel colostro con concentrazione fino a 7 g/L, mentre nel latte è 1 g/L.
Si trova anche nelle cellule neutrofile ed è uno dei componenti del sistema immunitario ed ha attività antimicrobica, funghicida e batteriocida, e fa parte del sistema innato di difesa principalmente nelle mucose.
La sua attività è inibita dai farmaci antiinfiammatori non stereoidei come l’aspirina.
La lattoferrina è venduto come integratore per ridurre il rischio di infezioni nel tratto respiratorio secondo alcune metanalisi, ma bisogna prestare attenzione alla qualità degli integratori venduti che non è la stessa della lattoferrina venduta come medicinale.
Struttura della lattoferrina
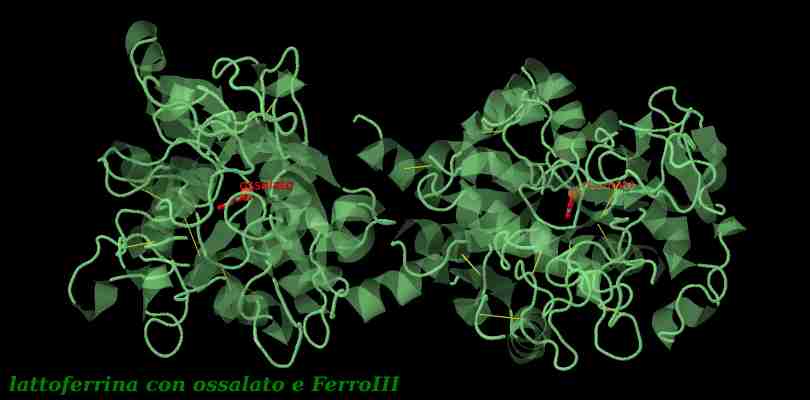
Dall’analisi di diffrazione ai raggi X si ricava che la lattoferrina è una catena di 700 amminoacidi che forma due domini globulari autonomi, il Lobo N, con gli amminoacidi da 1 a 333, e il Lobo C con amminoacidi da 334 a 692.
Ogni lobo consiste di 2 sottodomini, N1, N2, C1 e C2, e contengono un sito di legame del Ferro ed un sito di glicosilazione che determina il peso molecolare totale e anche la sua stabilità.
Ha un punto isoelettrico pari a 8.7 ed esiste in due forme: quella ricca di ferro, la Ololattoferrina, e quella povera di ferro la apolattoferrina, come mostrato poi nelle animazioni. Le due molecole sono differenti con la forma apo che è più aperta e che si chiude una volta che ha legato il Ferro. Questa stessa differente apertura si nota nei lobi N e C della Ololattoferrina.
Proprietà della lattoferrina
Molta dell’attività antimicrobica della lattoferrina proviene dalla sua capacità di sequestrare il ferro che serve all’attività microbica che migliora a pH leggermente acidi dovuti agli acidi che si formano nell’infiammazione.
La lattoferrina ha anche proprietà antivirali contro vari virus come quello dell’epatite C, il rotavirus e HIV. Verso di essa è cresciuto l’interesse perché potrebbe servire da molecola di trasporto di medicinali e mitigare così gli effetti secondari negativi.
Si tratta di una sola catena peptidica che forma due lobi formati da due sottodomini.
– Si noti come il FerroIII sia CHELATO dagli ossigeni del gruppo ossalato. Ogni lattoferrina può legare due atomi di Ferro o Rame o Zinco. Ogni ione è legato da sei atomi: due del carbonato o ossalato o carbonato, e 4 dalle catene di Amminoacidi: due tirosine, una istidina ed un acido aspartico.
– Visualizza il sito di legame del ferro e fai vedere le
Nei modelli descritti dopo sono visualizzate sia l’apoenzima (che non contiene Ferro) che l’Oloenzima che contiene il ferro. Si noti come le due strutture siano notevolmente diverse a testimoniare che il legame con Fe modifica la struttura dell’enzima da una forma aperta dell’APO alla forma chiusa dell’Oloenzima
–
–