E’ un processo termodinamicamente favorito perché porta ad un composto con energia minore, ed è una reazione esotermica secondo lo schema qui proposto.
Il processo, benché sia favorito termodinamicamente, richiede un’alta energia di attivazione, e miscele di alchene ed idrogeno non producono a temperatura ambiente alcuna reazione e prodotto visibile.
La presenza di catalizzatori metallici attivati rende possibile la reazione perché modificano il percorso secondo cui avviene e modifica l’energia dello stato di transizione. Come si sa i catalizzatori non possono modificare l’energia libera di reazione, né si consumano o producono essi stessi pur partecipando alla reazione.
Il meccanismo proposto ci porta ad una addizione di idrogeno che avviene con una stereoselettività in SIN, vale a dire che i due H entrano da uno stesso lato del doppio legame.
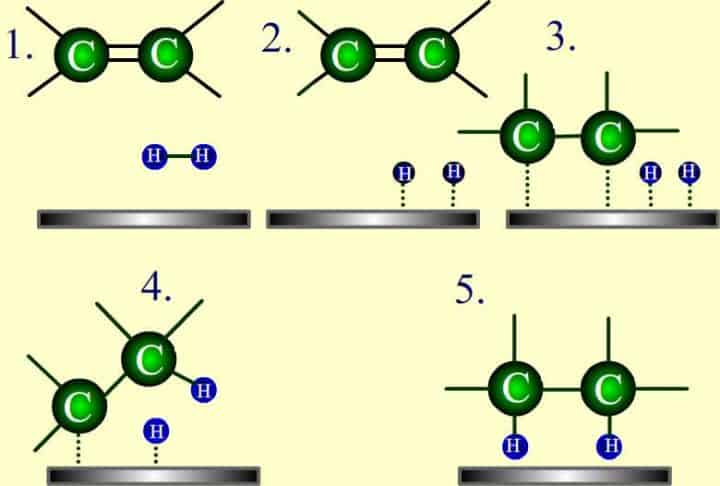
I catalizzatori in questo caso sono costituiti in genere da metalli, come Palladio, Platino e nichel, finemente divisi su una superficie ed il meccanismo ha luogo in due stadi.
Nel primo si ha un adsorbimento dell’idrogeno sul catalizzatore insieme allo stesso alchene.
Nel secondo stadio gli idrogeni adsorbiti si spostano dalla superficie del catalizzatore verso il doppio legame. Il meccanismo complessivo non è stato comunque ancora chiarito bene.
Nel caso reale il catalizzatore talvolta genera una isomerizzazione del doppio legame che potrebbe far perdere la stereoselettività del prodotto finale.
Esiste anche un procedimento di sin-idrogenazione che fa uso della diimmide, N2H2, composto instabile. I reagenti si generano nel sistema stesso di reazione per ossidazione dell’idrazina con sviluppo di forti quantità di calore.
Poiché la reazione di idrogenazione è fortemente esotermica, il calore di idrogenazione prodotto può essere usato per valutare la stabilità termodinamica degli alcheni
Perché ciò sia possibile gli alcheni differenti per idrogenazione devono condurre allo stesso alcano.
Si consideri a questo fine il calore di idrogenazione degli isomeri di tre alcheni C5H10 che per idrogenazione danno lo stesso 2 metilbutano.
Un alto calore di idrogenazione implica un’alta energia dei reagenti ed un loro alto valore è inversamente proporzionale alla stabilità dell’alchene. L’introduzione di un gruppo alchilico attorno al C=C stabilizza il doppio legame di 1kcal/mole.
Di seguito vediamo alcuni calori di idrogenazione degli alcheni.
CALORE DI IDROGENAZIONE DI ALCUNI ALCHENI
1-Butene + Idrogeno = Butano
| Quantità | Valore | Unità di misura |
| ΔH° | -30.10 ± 0.10 | kcal/mol |
Idrogeno + 2-Butene, (Z)- = Butano
| Quantità | Valore | Unità di misura |
| ΔH° | -28.33 ± 0.10 | kcal/mol |
Idrogeno + 2-Butene, (E)- = Butano
| Quantità | Valore | Unità di misura |
| ΔH° | -27.38 ± 0.10 | kcal/mol |
2-Butene, (Z) = 2-Butene, (E)
| Quantità | Valore | Unità di misura |
| ΔH° | -0.9 ± 0.5 | kcal/mol |
1-3 butadiene + 2 Idrogeno = butano
| Quantità | Valore | Unità di misura |
| ΔH° | -56.57 ± 0.10 | kcal/mol |
Cicloesene + Idrogeno = cicloesano
| Quantità | Valore | Unità di misura |
| ΔH° | -28. ± 1. | kcal/mol |
1-3 Cicloesadiene + 2 Idrogeno = cicloesano
| Quantità | Valore | Unità di misura |
| ΔH° | -53.64 ± 0.29 | kcal/mol |
1-4 Cicloesadiene + 2 Idrogeno = cicloesano
| Quantità | Valore | Unità di misura |
| ΔH° | -55.6 | kcal/mol |
Benzene + 3 Idrogeno = cicloesano
| Quantità | Valore | Unità di misura |
| ΔH° | -49.06 ± 0.15 | kcal/mol |
Più alto è il calore sviluppato meno energetico è l’alchene, ossia più stabile esso è. Da qui si ricava la regola che la stabilità degli alcheni dipende dalla loro ramificazione
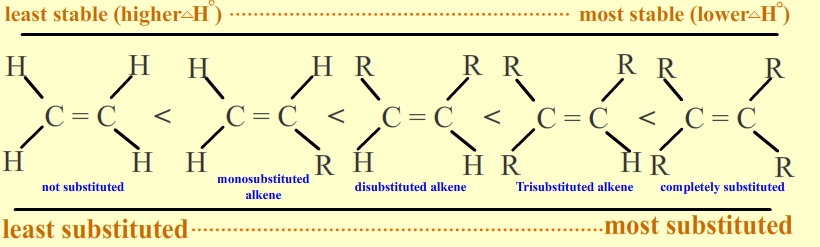
Si prenda il caso del 2-Butene che ha due stereoisomeri geometrici, E e Z. Quale dei due sarà il più Stabile?
Dai dati in tabella si ricava che il calore di idrogenazione dell’isomero geometrico cis 2-Butene(Z) è di -28,33 Kcal/mole, mentre quello dell’isomero geometrico trans E è -27,38 Kcal/mole con una differenza di 0,9 Kcal/mol a favore del più stabile isomero trans.
Il calore di Idrogenazione è anche usato per valutare la differente stabilità dei dieni, tra i doppi legami singoli e doppi legami coniugati.
1-3 cicloesadiene ha un’energia di idrogenazione di -26,82 Kcal/mole, mentre l’isomero 1-4, cicloesadiene ha -27,82 Kcal/mole. Il diene coniugato ha una stabilità maggiore del rispettivo diene nonconiugato di 1 kcal/mole, che rappresenta l’energia di risonanza del diene coniugato.
Ragionando sui dati del benzene troviamo che il suo calore di idrogenazione è di -49,06 Kcal/mole. Assumiamo come valore medio di un doppio legame il calore medio dei cicloesadieni, 27,32 Kcal/mole.
3 molecole di H2 dovrebbero sviluppare TEORICAMENTE perciò 27,32×3= 82kcal/mole contro i 49 kcal/mole reali con una differenza di circa 33 kcal/mole che sarebbe l’energia di risonanza del benzene.
I dati qui presentati sono stati tratti da Chemical Formula Search