Il metodo dei doppi reciproci, o diagramma di Lineweaver-Burk, è senza dubbio il più popolare e familiare delle tecniche manuali per il calcolo dei parametri cinetici.
Forse il metodo dei doppi reciproci, è anche il peggiore da usare per le ragioni che cercheremo di spiegare e dimostrare in seguito.
Per prima cosa però vediamo come si ottiene
Con una semplice conversione algebrica dell’equazione di Michaelis-Menten si ottiene la seguente espressione
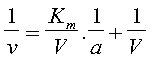
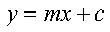
In questa espressione 1/v e 1/a sono le variabili e sono i reciproci della velocità e della concentrazione del substrato,mentre Km/V e 1/V sono costanti in quanto reciproco dalle costanti Km and V. Comparando questa espressione a quella di una retta
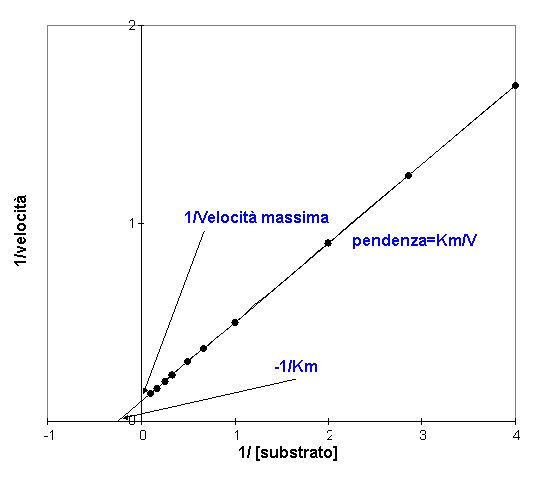
vedremo che hanno la medesima struttura. Ne consegue che, diagrammando le due variabili, 1/v contro 1/a, i punti si adageranno su una linea retta. Questo metodo risolve una delle obiezioni all’uso della curva v/[A]. Inoltre la retta può essere facilmente estrapolata fino ad incontrare gli assi
Questo sembra rispondere a molti problemi riguardanti il calcolo dei parametri cinetici dalla curva velocità contro concentrazione del substrato:
- E’ una linea retta che di per sè è più facile da tracciare
- Non richiede la misura diretta della Vmax
- La lettura di entrambe Vmax e Km può essere fatta prontamente dal grafico.
Sfortunatamente ha qualche inconveniente reale quando deve trattare dati sperimentali che hanno un errore sperimentale significativo, per cui non è raccomandato per la determinazione dei parametri cinetici, per i quali sono preferibili il metodo di Eadie-Hofstee oppure metodi di regressione non lineare.
Determinazione della Vmax
Dal grafico di Lineweaver-Burk e dall’equazione della retta possiamo vedere
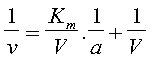
che il reciproco della Vmassima 1/Vmax è equivalente all’intercetta della retta con l’asse delle ordinate e ci darà la lettura immediata della 1/Vmax.
Da un punto di vista fisico, l’intercetta della retta avviene ad 1/a = 0 cioè quando la concentrazione del substrato è infinita. Per definizione ciò è il reciproco di Vmax
La pendenza della retta
Confrontando l’equazione di Lineweaver-Burk con quella della retta si può vedere che la pendenza della retta m è uguale Km/Vmax
Ricordando dalla discussione sull’equazione di Michaelis:
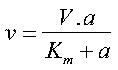
come a basse concentrazioni, la concentrazione del substrato è molto più piccola della costante, per cui Km + a sarà più o meno uguale a Km. In questo caso l’equazione diventa:
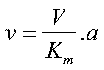
Dal momento che V e Km sono costanti si può notare come la velocità è direttamente proporzionale alla concentrazione del substrato. V/Km deve essere anch’esso costante e rappresenta la costante di velocità della reazione a basse concentrazione di substrato. La pendenza della retta di sù rappresenta l’inverso di questa costante di velocità.
La Determinazione della Km
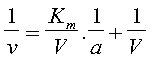
L’intercetta della retta con l’asse delle ascisse è indicato come -1/Km. Lo si può giustificare facendo un semplice ricorso all’algebra. Infatti passando l’asse orizzontale per l’origine, questo punto deve avere come 1/v un valore 0. L’equazione di Lineweaver-Burk
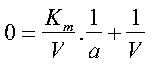
perciò diventa
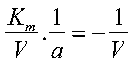
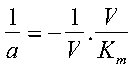
Portando 1/V dall’altro lato:
e dividendo entrambi i membri per Km/V:
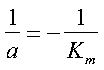
Semplificando si ottiene:
Perciò l’intercetta della retta con l’asse delle ascisse ha le coordinate -1/Km, 0.
Problemi con il grafico dei doppi reciproci
Il primo svantaggio del metodo dei doppi reciproci è che nel suo grafico i punti ad alta concentrazione di substrato sono tutti addensati in una zona ristretta della retta, mettendo invece in risalto i punti in cui si ha minore concentrazione del substrato.
L’errore commesso nelle misure non è uguale in tutti i punti del grafico e fare il reciproco accresce l’errore proprio sui valori più bassi delle variabili.
La retta che così si disegna presenta incertezze notevoli.
Di qui i valori di Vmax e Km non sono assolutamente attendibili.
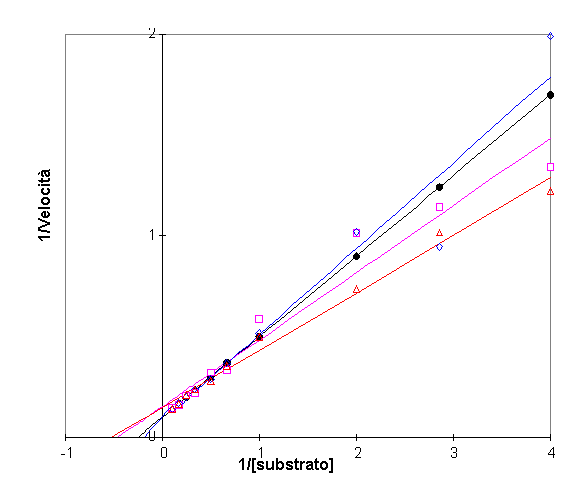
Nel grafico di su si sono usati dati di un enzima ipotetico con un valore presunto di Vmax e Km (Vmax =10, Km =4) con cui si creano dei punti e studiare i grafici. A tutti questi punti poi si è aggiunto un errore casuale per vedere come l’errore influenzi il grafico.
Gli stessi dati sono stati diagrammati col metodo di Lineweaver Burk e si può notare come essi siano alquanto diffusi, specie nella parte destra del grafico che indica i dati a più bassa concentrazione di substrato.
In questa zona il diagramma ha esasperato l’errore a bassa concentrazione dove di solito le misure sono le meno accurate con la velocità che decresce.
Le rette ricavate con l’equazione dei doppi reciproci di Lineweaver Burk comunque sono utili nelle presentazioni e nello studio del tipo di inibizione, se competitiva, non competitiva, acompetitiva.
Di seguito diamo alcuni valori di Km e Kcat di alcuni enzimi
| Enzima | Substrato | Valore Km | Valore Kcat |
| Catalasi | H2O2 | 25 | 40.000.000 |
| Anidrasi Carbonica | HCO3- | 9 | 400.0000 |
| Chimotripsina | gliciltirosinilglicina | 108 | – – – |
| Chimotripsina | N-benzoiltirosinamide | 2,5 | – – – |
| Esochinasi | ATP | 0,4 | – – – |
| Esochinasi | D-glucosio | 0,05 | – – – |
| Esochinasi | D-fruttosio | 1,5 | – – – |