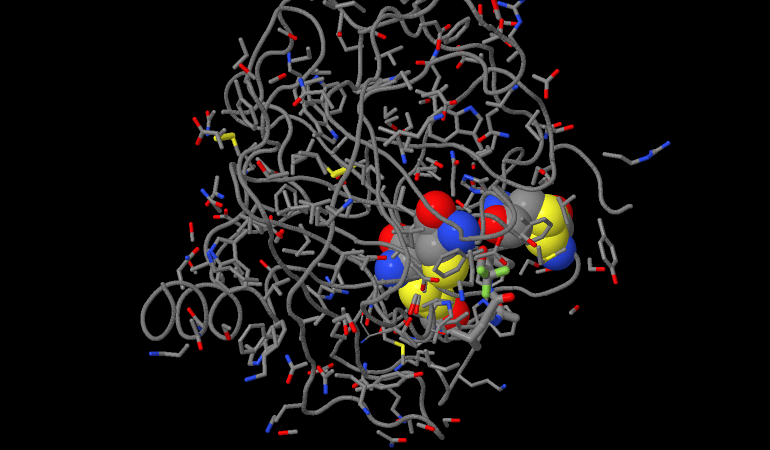
Si parla di inibizione enzimatica quando una molecola modifica l’attività di un enzima, rallentandola o bloccandola
La molecola inibitrice si lega all’enzima e ne può modificare la struttura portando finanche anche alla distruzione della struttura dell’enzima stesso.
Sono inibitori anche tutti quei fattori chimici e fisici che modificano la struttura proteica dell’enzima come pH, temperatura, tensioattivi, acidi e basi o urea.
Molti di questi fattori possono causare anche la denaturazione della parte proteica o una modifica della struttura quaternaria e/o terziaria.
In quest’ultimo caso si parla di inibizione aspecifica.
La inibizione enzimatica può essere: inibizione reversibile ed irreversibile a seconda della natura del legame tra inibitore ed enzima
L’inibizione enzimatica si dice IRREVERSIBILE quando il legame chimico tra SITO ATTIVO dell’enzima e INIBITORE è un legame covalente forte che non può essere invertito facilmente.
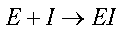
Si parla in questo caso di inattivatori enzimatici.
I metalli pesanti, come Hg, Cd o Pb, sono un caso di inibizione irreversibile specifica perché essi, (ma anche altre molecole come i gas nervini sull’acetilcolinesterasi), si legano in modo forte al sito attivo dell’enzima causando anche la sua denaturazione.
Gli amminoacidi presenti nel sito attivo dell’enzima che sono suscettibili all’inibizione irreversibile sono la Serina, gruppo -OH degli enzimi serinici, e la cisteina, con gruppo -SH degli enzimi cisteinici.
Le penicilline per esempio inibiscono irreversibilmente l’enzima transpeptidasi nella sintesi della parete cellulare perché si legano irreversibilmente alla serina del sito attivo dell’enzima.
L’inibizione enzimatica si dice REVERSIBILE quando l’inibitore non degrada la proteina e si lega in modo reversibile al sito attivo o alla proteina stessa in un sito allosterico.
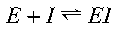
L’inibizione REVERSIBILE è classificata in tre grandi classi a seconda dei parametri cinetici che vengono modificati:
Si parla di Inibizione Competitiva, di non competitiva, inibizione acompetitiva, e inibizione non-competitiva.
I parametri cinetici che vengono modificati sono Km e Vmax.
In tutti questi casi rimuovendo l’inibitore si ripristina l’attività dell’enzima.
Lo studio del tipo di inibizione enzimatica comincia appunto con lo studio dei parametri cinetici degli enzimi anche attraverso l’andamento della retta dei doppi reciproci ed è uno dei capisaldi dello studio dei cicli metabolici e della vita stessa, come anche dello studio dell’effetto dei farmaci.