Le proteasi, o enzimi proteolitici, sono una classe di proteine che spezzano altre proteine attraverso l’idrolisi del legame ammidico in sequenze di amminoacidi particolari che dipendono dall’enzima particolare.
Perciò la loro classificazione si basa sugli amminoacidi che catalizzano la reazione di idrolisi.
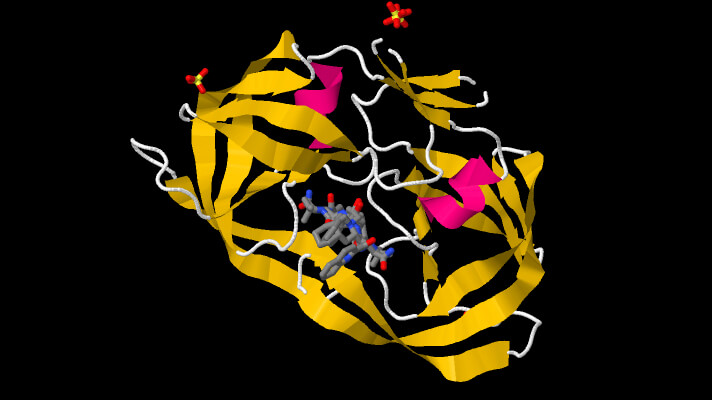
Abbiamo le proteasi SERINICHE che contengono nel SITO CATALITICO l’amminoacido SERINA oltre ad una istidina ed un acido aspartico a formare la propria triade catalitica. Tutte le seriniche sono caratterizzate appunto da questa triade catalitica.
Queste proteasi lavorano in due stadi. Nel primo formano un intermedio covalente con la proteina che intendono idrolizzare con la serina; nel secondo stadio una molecola d’acqua entra e permette il rilascio della proteina divisa.
Nelle proteasi CISTEINICHE l’amminoacido nucleofilo chiave è la CISTEINA, mentre nelle SERINICHE il nucleofilo è la SERINA.
Tra le proteasi seriniche troviamo molti enzimi digestivi come la Tripsina, Chimotripsina ed Elastasi.
Mentre la triade catalitica è la stessa in tutte e tre, si differenziano per il punto in cui idrolizzano la proteina perché nella sacca di legame che lega la proteina da idrolizzare ci sono differenti gruppi funzionali.
La chimotripsina preferisce un residuo idrofobico grande, la sua sacca di legame è grande e contiene residui idrofobici. (vedi chimotripsina)
La Tripsina è particolare per residui caricati positivamente come la lisina e nel fondo della sacca di legame conterrà amminoacidi cariche negativamente.
Le elastasi preferiscono residui neutri piccoli e la sua sacca è anche piccola.
Le proteasi della cisteina hanno un ruolo nella regolazione dei processi cellulari come le Caspasi e Deubiquitinasi. Una proteasi cisteinica è la Papaina, presente nel frutto della papaia, che affronteremo a parte.
Un’altra classe di proteasi sono quelle dell’aspartato e tra queste troviamo quelle del HIV.
HIV produce le proteine che gli servono sotto una unica catena che poi la proteasi scinde nelle singole unità funzionali. Dal momento che scinde proteine lunghe deve avere un tunnel per accomodare il lungo substrato proteico e delle sezioni della proteina che si aprono e chiudono per permettere al substrato e prodotti di entrare ed uscire.
Le proteasi dell’aspartato contengono nel sito attivo due residui aspartato.
Una terza classe di proteasi sono le metalloproteasi, come le carbossipeptidasi che idrolizzano l’amminoacido C terminale di una proteina.
Nel sito attivo ci sta uno ione Zn2+ che è complessato alla proteina attraverso interazioni con istidina, serina e acido aspartico. (Fonte Proteopedia)
Amminoacidi
–– –
Enzimi Proteolitici
– –
– –