Gli inibitori noncompetitivi si legano al loro sito sull’enzima, lontano dal sito attivo, causando un cambio nella conformazione del sito attivo stesso che non lo fa funzionare bene.
In ciò è molto simile agli inibitori competitivi con la differenza che il substrato si lega comunque al sito attivo ma esso non viene più convertito in prodotto come esemplificato dall’animazione.

I classici inibitori noncompetitivi non hanno influenza sulla capacità di legarsi del substrato sull’enzima, anche se il sito attivo è stato modificato nella sua forma e l’affinità sarà comunque ridotta.
Questi inibitori misti noncompetititvi sembrano avere alcune proprietà dei competitivi e dei non competitivi. Di fatto inibitori classici non competitivi sono rari, se esistono del tutto.
Questi possono essere distinti dai competitivi per il loro effetto sui parametri cinetici.
Cinetica degli inibitori Noncompetitivi
Allo stesso modo di un inibitore competitivo, nel noncompetitivo l’enzima può legarsi al substrato o all’inibitore per formare i complessi Enzima-inibitore ed/o enzima-substrato, secondo gli equilibri
Questa volta però substrato ed inibitore possono legarsi contemporaneamente all’enzima formando un complesso ternario che non è capace di generare il prodotto
Si noti che il complesso ternario si può generare secondo due percorsi differenti che portano però al medesimo risultato, un complesso inattivo. L’inibitore può lavorare bene anche a basse concentrazioni di substrato quando l’enzima è essenzialmente nella forma libera, come ad alte concentrazioni quando l’enzima è sotto forma di complesso col substrato, dal momento che può legarsi bene ad entrambi E ed EA
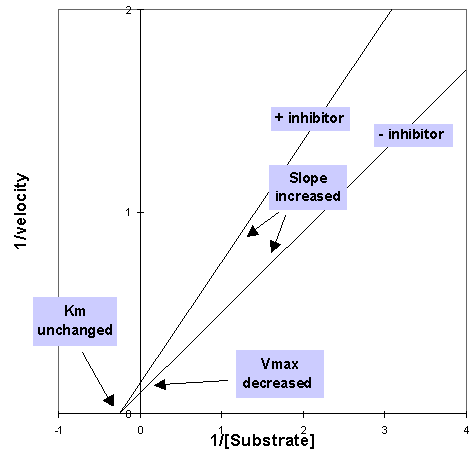
Effetti su Km
I classici inibitori noncompetitivi non hanno un tipo di effetto sulla formazione del legame substrato enzima, perciò l’affinità e di conseguenza Km rimangono invariati.
Nel caso di inibitori misti, viene ridotta l’affinità per il substrato e Km viene aumentato nonostante che il substrato si leghi comunque all’enzima.
Effetti su Vmax
I non competitivi sia classici che misti inibiscono anche ad alte concentrazioni di substrato, perciò Vmax è abbassata
Effetti suVmax/Km
I noncompetitivi lavorano anche a basse concentrazioni di substrato perciò Vmax/Km deve decrescere
Il grafico di Lineweaver-Burk
Il grafico seguente di Lineweaver-Burk è tipico di un classico inibitore noncompetitivo
Un inibitore misto darebbe un grafico simile al seguente
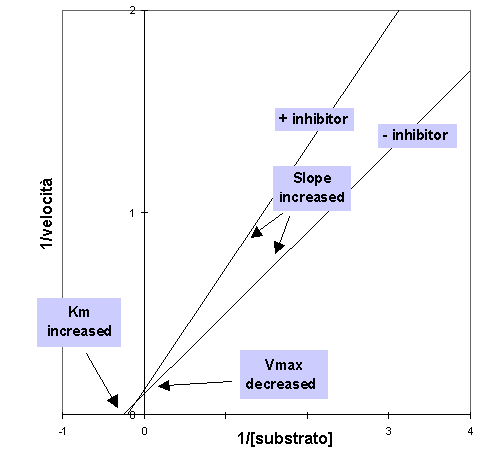
Si noti che nel secondo grafico le due rette hanno intercette differenti con l’asse delle ascisse 1/[Substrato], mettendo in mostra un incremento di Km, mentre nel primo grafico i valori di Km sono identici.
Entrambi comunque mostrano un incremento nell’intercetta dell’asse delle ordinate (1/V) e nella pendenza, il che dimostra che l’inibizione è efficace sia ad alte che a basse concentrazioni di substrato.
Riepilogo
Gli inibitori noncompetitivi si legano al sito di inibizione che è lontano dal sito attivo. Inibiscono la catalisi enzimatica poiché causa un cambiamento nella conformazione che impedisce all’enzima di trasformare il substrato in prodotto.
Substrato e inibitore possono legarsi entrambi all’enzima allo stesso tempo e generare un complesso ternario. Questo comporta che l’inibitore non è espulso per competizione da alte concentrazioni di substrato e che possa lavorare bene sia ad alte che a basse concentrazioni di substrato.
Di solito benché il substrato possa legarsi al complesso enzima inibitore, ne viene ridotta comunque la sua capacità. Questo è quello che talvolta viene chiamata cinetica mista, però non c’è una reale differenza di meccanismo tra gli inibitori misti e un classico noncompetititvo.