Si ritrova questa mutasi in ogni organismo in cui vi è la glicolisi, dai batteri ai lieviti agli esseri umani.
La fosfoglicerato mutasi è formata da due classi.
La prima è una indipendente dal 2,3-bifosfoglicerato, un metalloenzima, iPMG, e l’altra che richiede questo composto come primer per fare partire la reazione, dPMG. I meccanismi di reazione sono differenti nei due casi.
In molte specie i due enzimi si trovano contemporaneamente.
“L’enzima iPMG lo si ritrova nelle piante superiori, alghe, alcuni funghi, nematodi, celenterati, aracnidi, archea ed alcuni batteri G+. Ha la massima attività in assenza del 2,3-bifosfo-D-glycerato. Contiene due atomi di Mn2+ (anche Co2+ in alcune specie). La reazione coinvolge una reazione di fosfotransferasi alla serina seguita al trasferimento al glicerato in altra posizione.” originale
Nei mammiferi si trovano due tipi di subunità, M oppure B ed esiste in prevalenza come dimero di questi tre tipi di subunità, MM BB oppure MB. MM lo si ritrova nei muscoli lisci, mentre MB nel muscolo cardiaco e scheletrico ed il BB negli altri tessuti.
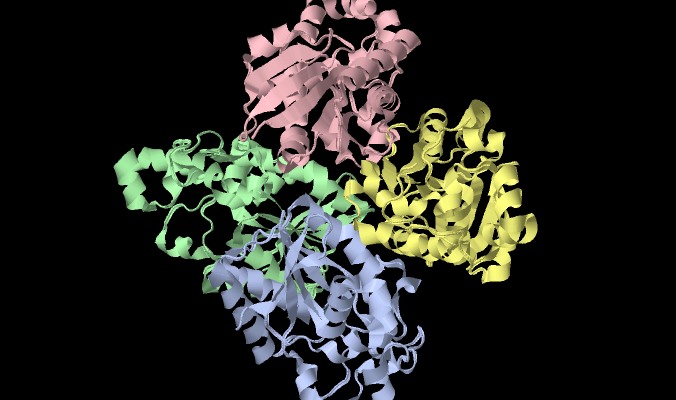
La PGM è classificata come proteina alfa/beta. Il dimero ha un peso molecolare di 56000 a 60 mila kDa, mentre quello del lievito ha un peso molecolare di 110000 kDa. (originale Proeopedia)
Nelle animazioni che seguono considereremo la dPMG che per funzionare ha bisogno del cofattore 2,3-difosfo D glicerato.
3PG + P-Enzima → 2,3 difosfoglicerato + Enzyma → 2-fosfoglicerato + P-Enzima
Questa reazione, in cui il fosfato sul carbonio 2 non è quello che originariamente era sul C3, ha una variazione dell’energia libera di Gibbs di +1,1kJ/mole.
Procederà quindi solo se i successivi stadi di decomposizione dal PEP ad acido piruvico con produzione di ATP saranno compiuti.
Secondo studi cinetici, sia la classe dell’enzima indipendente che dipendente dal cofattore seguono la cinetica di Michaelis Menten. I valori delle Km variano da 100 a 200 μM a seconda della presenza di ioni carichi negativamente che possono competere col substrato carico negativamente. Il pH ottimale è 5.9.
Gli inibitori competitivi assomigliano al substrato carico negativamente e si legano al sito attivo tra cui anche EDTA.
SITO ATTIVO della dPMG
Gli amminoacidi più importanti sono l’Istidina 8 e Istidina 181, i cui anelli imidazolici sono vicini ai due C interessati dalla transfosforilazione del substrato 2PGA.
I siti attivi della fosfoglicerato mutasi sono ben separati sia nel dimero che nel tetramero, in solchi profondi in ogni subunità.
Hys8 è prima fosforilato durante la catalisi da un fosfato del cofattore che sarà poi trasferito al prodotto finale 3PG sul Carbonio 2 con la formazione di un complesso del cofattore con l’enzima. C’è perciò un fosfato legato in modo covalente al sito attivo del monomero.
In questo passaggio probabilmente Hys 179 agisce da accettore donatore di protone.
Successivamente il fosfato che si trova sul C 3 del substrato è trasferito al Hys 8 rigenerando il sito attivo.
I residui di amminoacidi importanti sono His 179, His 8, Glu 15, Ser 11, Tyr 20, Arg 59 e Glu 86.
Molti sono caricati positivamente nel sito attivo, per lo più le arginine che sono fondamentali per la migliore attività dell’enzima. D’altronde il substrato che si lega è caricato negativamente.
Ai Glu 15 ed 86 è data importanza perché con i loro gruppi carbossilici possono attirare protoni standosene sui lati del substrato.
–
–
Reagenti ed intermedio della dPMG
Le molecole qui rappresentate sono gli acidi corrispondenti agli ioni agenti effettivamente nell’enzima
– – –
Sito attivo della dPGM
– Poiché i substrati ed i prodotti sono caricati negativamente a quel pH, catene laterali positive selezionano, stabilizzano e bloccano gli anioni. Da notare che i due substrati qui sono 3PG e lo ione Solfato, il quale ha grandezza comparabile col fosfato ma è inattivo. Se si esamina il 3PG si noteranno le strutture sovrapposte del solfato e fosfato.
– – –
In un prossimo post esamineremo la fosfoglicerato mutasi indipendente dal cofattore che adotta un altro mecanismo basato sullo ione Mn2+ oppure Co2+.