Nella produzione di energia il GAPDH catalizza la sesta reazione del catabolismo del glucosio, glicolisi, che avviene nella gran parte dei microrganismi.
Esso consiste nell’ossidazione del GAP da parte del NAD+ insieme ad uno ione fosfato organico a produrre 1,3 bifosfoglicerato.
Nella fotosintesi che sono portate avanti dalle piante e dalle alghe, questo stesso enzima utilizza NADPH nella reazione inversa in un passaggio del ciclo di Calvin che fissa la CO2 in carboidrati.
Insieme a queste che sono le sue funzioni principali il GAPDH ha anche altre funzioni come l’attivazione della trascrizione, iniziazione della apoptosi e nel trasporto dal reticolo endoplasmatico all’apparato di Golgi. Ci soffermiamo però sulla glicolisi.
La Struttura dell’enzima GAPDH
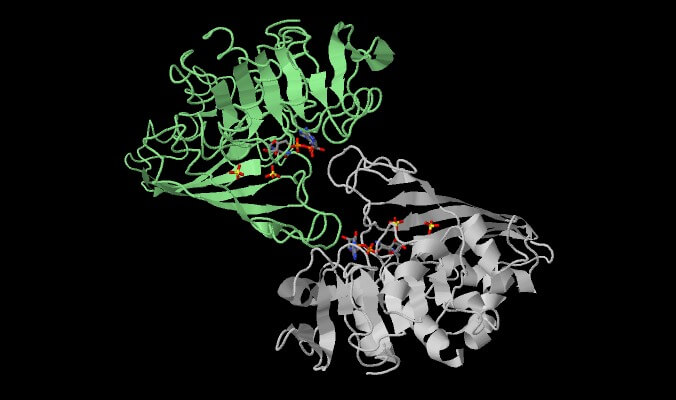
GAPDH esiste sotto forma di dimero con alcune peculiarità interessanti. I due monomeri dell’enzima non sono identici.
Una parte consiste solo di strutture a pieghe parallele ed antiparallele, mentre l’altra è costituita di sia di alfa eliche che beta a pieghe.
Sebbene le due parti non abbiano la stessa sequenza esatta, ognuna contiene lo stesso sito attivo e la funzione.
GAPDH catalizza la seguente reazione
Questo enzima non è fortemente regolato a causa degli stati di transizione ad energia relativamente bassa tra il quinto e nono passaggio.
Ma per funzionare devono esserci alcuni elementi. GAPDH è inattivato dall’alchilazion dello iodoacetato in cui lo Iodio inibisce il sito attivo legandosi alla Cistina 151 del sito attivo. Se esso è presente la reazione si fermerà.
Il NAD+ inoltre ossida il GAP con un tasso che dipende anche dallo ione fosfato. Questo stadio non è regolato perché lo ioduro non è presente nel sangue e l’assenza di H+ e fosfato causeranno la reazione a fermarsi prima che si arrivi a questo stadio.
Meccanismo della reazione
Il primo passaggio del meccanismo alquanto semplice è l’attacco dello zolfo della Cistina 151 al carbonio aldeidico a formare un tiosemiacetale. Questo intermedio subisce l’ossidazione per trasferimento di un H- verso il NAD+ a formare un tioestere.
Un gruppo fosfato entra ed attacca lo stesso carbonile mentre allo stesso tempo è separato dalla cistina dal istidina 178 protonata. Si forma il prodotto 1,3difosfoglicerato.
Ad influenzare il processo catalitico ci sono anche la tirosina 210 e arginina 233 in quanto legano i reagenti.
La regolazione del GAPDH avviene attraverso il suo accoppiamento con la reazione del PGK, fosfoglicerato cinasi.
L’accoppiamento è necessario per il DeltaG’ leggermente positivo. il Delta G largamente negativo di questo processo del PKG porta a compimento della reazione complessiva
GAP + Pi + NAD+ + ADP ==> 3PG + NADH + ATP Delta G’ di -12 KJ/mole
(link originale http://proteopedia.org/wiki/index.php/Nathan_Line_sandbox_3)
La GAPDH è
Si noti come le due subunità siano leggermente differenti. Mentre una è costituita da alfa eliche e beta a pieghe l’altra è costituita solo di beta a pieghe.
Sebbene le due subunità non siano uguali per sequenza degli amminoacidi, riescono a replicare il sito attivo e le sue funzioni.
I due amminoacidi che fanno la catalisi sono Altri come contribuiscono a legare il NAD al sito attivo dell’enzima