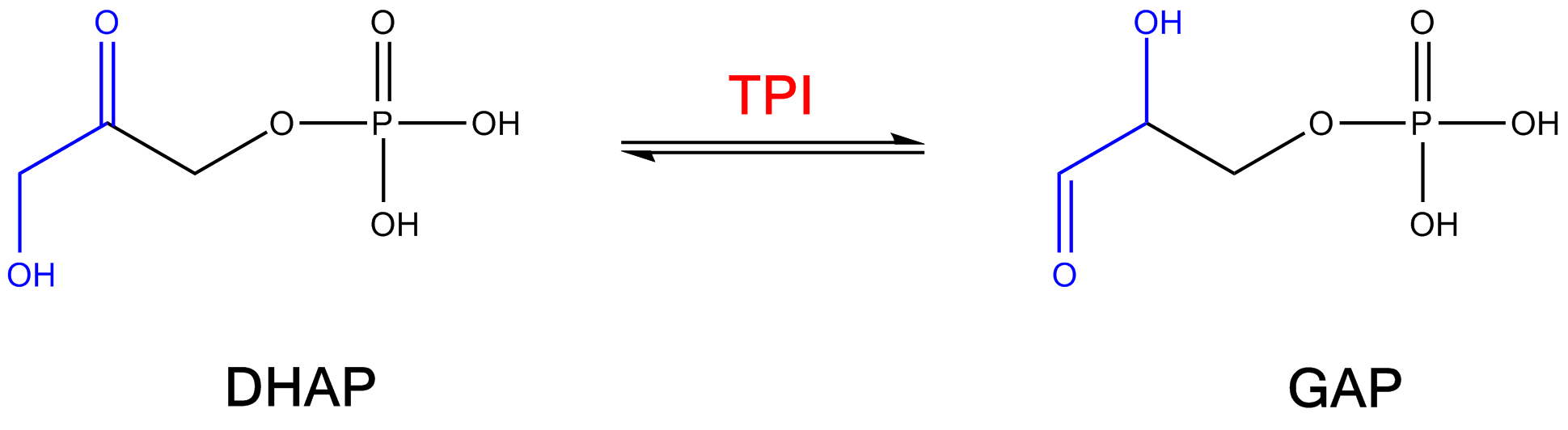
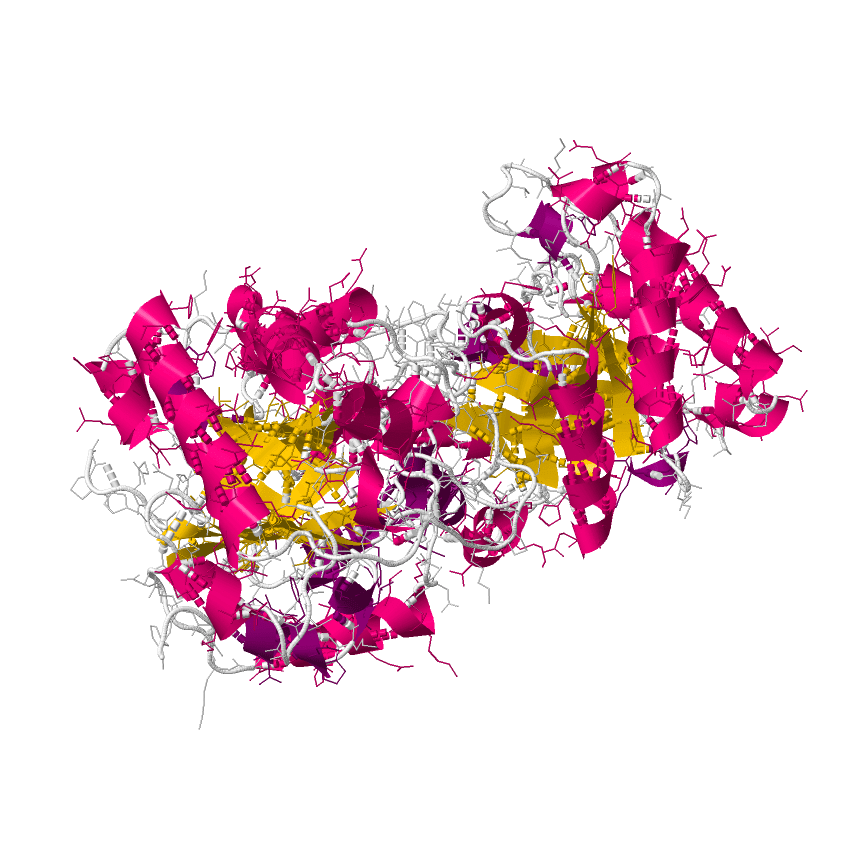La trioso fosfato isomerasi, conosciuta anche come TPI oppure TIM, è un enzima dimero molto comune del peso molecolare di 27 kD per subunità, 54 D, la cui funzione nel percorso metabolico della glicolisi è di catalizzare la conversione tra il DHAP e GAP, cioè da diidrossiacetonefosfato a 3-fosfo- D-gliceraldeide.
La struttura del monomero della TPI è una tipica struttura TIM a barile come si vede dall’immagine.
La struttura secondaria consiste di 14 alfa eliche ed 8 beta a pieghe per monomero ed è classificata come proteina alfa-beta. La struttura terziaria è un Barile alfabeta, prototipo del Barile TIM. La struttura quaternaria è costituito da un omodimero che rappresenta l’enzima funzionante.
Questo enzima funziona solo come DIMERO in quanto dalla struttura che si può vedere in seguito un loop di una catena si allunga fino al sito attivo dell’altra catena con una serie di legami ad H con gli amminoacidi del sito attivo.
Trioso fosfo isomerasi nella glicolisi
Da un punto di vista enzimatico la trioso fosfato isomerasi è un enzima perfetto perché è controllato cataliticamente solo dalla diffusione del substrato e quindi non ha inibizioni da substrato e/o prodotto. I controlli allosterici principali avvengono sulla fosfofruttochinasi.
L’equilibrio DHCP GAL è un passo essenziale della glicolisi che precede gli step della sintesi del ATP della fosforilazione a livello di substrato.
In termini di chimica organica è un esempio di isomerizzazione da chetoso in aldoso, equilibrio chetoenolico, che passa attraverso un derivato endiolico.
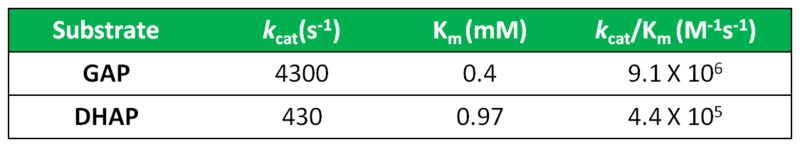
L’equilibrio DHCP GAP è totalmente spostato verso la forma chetonica del DHCP che è presente al 96% ed è il più stabile quindi termodinamicamente. Dal punto di vista cinetico si vede però che la velocità di formazione del GAP è la maggiore
.
Quando il GAP viene usato per produrre l’ATP ed essere trasformato in piruvato, l’equilibrio DHCP GAL si sposta verso la formazione di altro GAL. E’ un classico esempio di controllo cinetico e termodinamico che serve controllare il flusso di massa nella glicolisi.
Dove si trova la Trioso fosfato isomerasi
La Trioso fosfato isomerasi è coinvolta anche in altri percorsi metabolici come la gluconogenesi, lo shunt dei Pentosofosfati e la biosintesi degli acidi grassi.
Quando l’amminoacido alla posizione 104 è sostituito per mutazione un acido glutammico, GLU104, si ha una deficienza di trioso fosfato isomerasi, un disordine ereditario recessivo che impedisce la formazione del dimero dell’enzima. Si verifica un accumulo di DHAP negli eritrociti per inibizione dell’attività enzimatica.
Da un punto di vista squisitamente chimico si tratta di un equilibrio chetoenolico attraverso il fenomeno della tautomeria
Le due molecole: DHCP, o diidrossiacetone fosfato, e Gliceraldeide 3fosfato o GAP
– – L’ è ipotizzato come intermedio durante la catalisi.
Sito Catalitico
Consideriamo una particolare in cui è legato il PGA che è inibitore dell’enzima. Passiamo a vedere gli amminoacidi che tengono legato il substrato GAP.
. Il glutammato165 agisce da base e prende un protone da C2 del GAP, mentre Istidina95 ha un H per fare un legame ad H con il carbonile. La Lisina 13 invece stabilizza l’intermedio endiolico che è caricato negativamente.
Successivamente l’intermedio endiolo viene convertito in DHAP perché GLU 165 dona un protone al C1 e istidina 95 rimuove un protone dal OH del C2.
Il meccanismo di stabilizzazione vede anche una serie di amminoacidi dalla posizione 167 alla 176, Loop Flessibile, che avvicinandosi favoriscono lo stato di transizione dello ione enolato.
–
ricavato dal pollo in due conformazioni aperta e chiusa
Nel video presentato si può capire il ruolo del Loop flessibile nel meccanismo dell’enzima
Lavoro Originale in Proteopedia.org