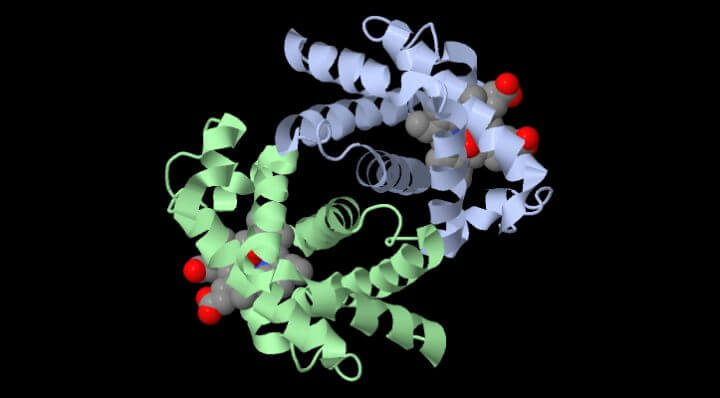
La forma che qui presentiamo è nella forma di deoxiemoglobina, priva di Ossigeno. La sua struttura è tutta di alfaeliche, collegate mediante dei gomiti e giri. Al centro di ogni subunità c’è un gruppo prostetico EME al cui centro vi è un atomo di Ferro II a cui si lega l’ossigeno. Per essere trasportato nei tessuti dai polmoni.
“L’ emoglobina è una straordinaria macchina molecolare che usa il movimento e piccole variazioni strutturali per regolare la sua azione. L’ossigeno non si lega contemporaneamente ai quattro gruppi eme nell’emoglobina. Il primo gruppo eme che lega l’ossigeno produce delle piccole modifiche nella struttura della catena proteica a cui è legato. Questi cambiamenti strutturali premono leggermente le catene vicine che assumono una forma diversa, e le inducono a legare l’ossigeno più facilmente.
Così, è difficile legare la prima molecola di ossigeno, ma legare la seconda, la terza e la quarta molecola di ossigeno diventa via via sempre più facile.
Questo aiuta molto la funzione dell’emoglobina.
Quando il sangue è nei polmoni, dove l’ossigeno è abbondante, l’ossigeno si lega facilmente alla prima subunità e poi rapidamente riempe tutte le subunità rimanenti.
Poi, quando il sangue circola attraverso il corpo, il livello di ossigeno scende velocemente mentre aumenta quello di biossido di carbonio. In questo ambiente, l’emoglobina rilascia l’ossigeno legato. Appena viene rilasciata la prima molecola di ossigeno, la proteina comincia a cambiare la sua forma. Questo induce i tre ossigeni rimanenti ad essere rilasciati rapidamente. In questo modo, l’emoglobina raccoglie il carico di ossigeno più grande possibile nei polmoni, e lo consegna tutto dove e quando ce n’è bisogno.
In questa figura animata, il gruppo eme di una subunità, mostrato nella piccola finestra circolare, viene mantenuto fermo in modo che si possa vedere come la proteina gli si muove attorno quando l’ossigeno si lega.
La molecola di ossigeno è mostrata in verde azzurro. Quando l’ossigeno si lega all’atomo di ferro nel centro dell’eme, tira verso l’alto l’amminoacido istidina che si trova sul lato inferiore dell’eme. Questo sposta la posizione di un’intera alfa-elica, mostrata qui in arancione sotto l’eme. Questo moto si propaga a tutta la catena proteica e alle altre catene, provocando alla fine il grande moto di oscillazione delle due subunità mostrate in blu” (per visualizzare il movimento vai a RCSB.org)
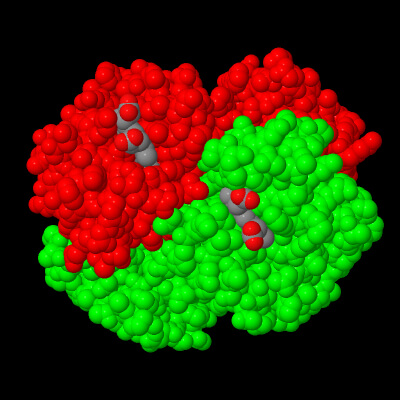
Evidenziamo le . Si notino oltre alle quattro unità anche il gruppo prostetico eme al cui centro esiste un atomo di ferro bivalente.
Qui evidenziamo le subunità costituite dalle catene A e C e colorate in Verde.
Qui si possono evidenziare colorate in rosso, costituite dalle B e D.
In quest’altra visualizzzione si possono vedere sepolti nella proteina che offrono solo i gruppi carbossilici al contatto con l’acqua.
In quest’altra visualizzazione possiamo osservare meglio
Per vedere l’intorno chimico dei gruppi eme si veda l’articolo sulla mioglobina. Si veda anche la pagina sull’emoglobina su Proteopedia.org