La lattato deidrogenasi esibisce molte proprietà peculiari tra le quali una cinetica enzimatica differente dalla Michaelis Menten e una cinetica sigmoidale.
Questo enzima può regolare e modulare la propria cinetica con varie molecole effettori, la possibilità di avere un effetto cooperativo da substrato, qualità tutte che li pongono al centro di un qualunque percorso metabolico, sia per la loro capacità catalizzatrice che per le possibilità di controllo del ciclo, cioè la modulazione allosterica.
In ogni subunità di questi enzimi si trova almeno un sito catalitico dove i substrati vengono trasformati in prodotti ed i siti di regolazione, dove gli effettori si legano e modificano la conformazione dell’enzima e con esso la sua capacità catalitica. Gli effettori sono detti anche Modulatori allosterici.
Questi enzimi oligomerici si trovano sotto forma di due conformazioni dette Conformazione TESA e Conformazione Rilassata, che sono in equilibrio tra loro.
La forma tesa in generale ha poca affinità con il substrato, mentre la forma rilassata ha più affinità per esso. Quando il substrato si lega all’enzima nella sua conformazione rilassata, l’equilibrio tra le due conformazioni viene spostato.
Sono due le ipotesi servono a spiegare la modulazione allosterica: il modello di Monod e quello di Koshland.
Uso industriale della Lattato idrogenasi
L’acido lattico che si forma è in genere l’acido L-Lattico, ma ci sono microrganismi capaci di sintetizzare il suo enantiomero acido D Lattico.
Sono utili nella conversione del latte a Yogurth come pure nella fermentazione di altri alimenti. Il legante FBP è una molecola che si forma negli stadi iniziali della glicolisi e serve a convertire l’enzima in una forma attiva, la subunità R.
Nelle cellule umane vengono formate due grandi tipi di LDH: la forma M e la forma H.
La forma M la si trova nei muscoli scheletrici e converte bene piruvato a lattato, ed è pronto quindi all’esercizio anaerobico.
La forma H fa molto meglio la reazione inversa da lattato a piruvato e la si trova nel cuore che è irrorato di ossigeno e può usare il lattato come fonte di atomi di C e di energia.
I due tipi, di struttura molto simile, formano complessi misti a seconda del tipo di cellula che li ospita.
Nelle fermentazioni, molti batteri ricavano energia sotto forma di ATP ossidando il glucosio nella fase glicolitica fino all’acido piruvico.
Per ripristinare l’agente ossidante NAD+ a partire da NADH, necessario per fare le ossidazioni nella glicolisi, NADH viene ossidato a NAD+ a spese dell’acido piruvico che si trasforma in acido lattico.
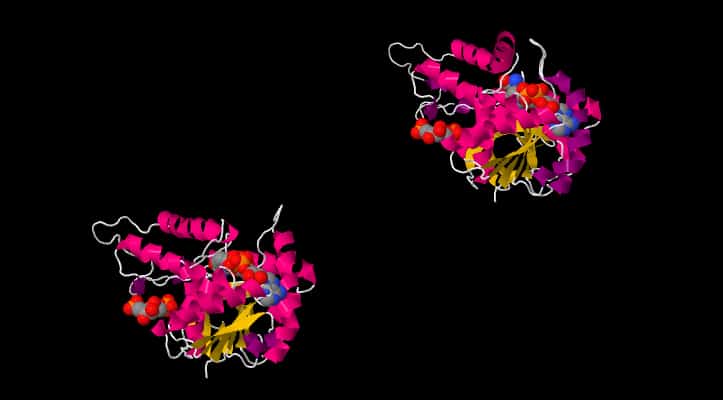
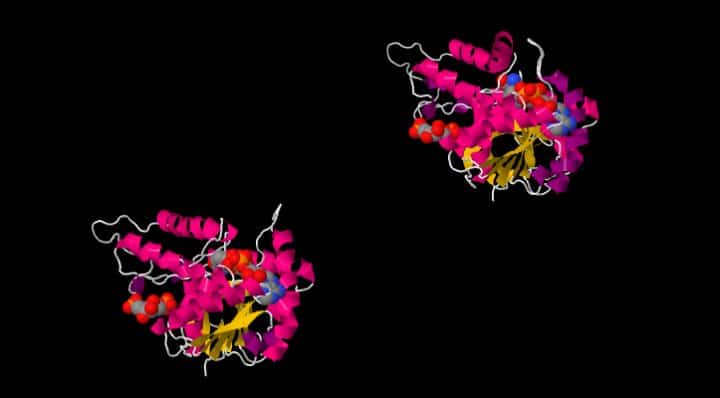
Di seguito visualizziamo la L-Lattato deidrogenasi Batterica del Bifidobacterium longum, in cui ci sono in quantità equimolecolari lo stato R e lo stato T, che formano un tetramero.
Sono anche presenti il Beta fruttoso 1-6 di fosfato (FBP), il NAD cofattore che ossida e l’acido Oxamico OXM. File originario presso RCSB
– – .
La non perfetta sovrapposizione tra le catene proteiche di R e T come anche dei substrati giustifica il differente comportamento e l’attività delle due catene nella reazione.