L’emoglobinaS è una emoglobina che si origina da una mutazione di un singolo amminoacido nelle catene Beta, da acido glutammico a Valina.
In articoli precedenti abbiamo analizzato la struttura della emoglobina che ha la funzione di trasportare l’ossigeno ai tessuti.
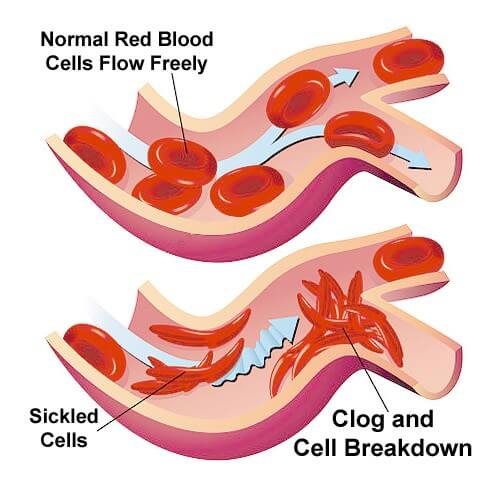
Quando si ha la modificazione genetica dell’emoglobina con formazione dell’emoglobinaS si ha anche una modifica della forma del globulo rosso che diventa falciforme con conseguenze gravi.
Le malattie delle cellule falciformi è il nome assegnato ad un gruppo di condizioni ereditate che colpisce la cellula del globulo rosso, la più gravi delle quali è l’anemia falciforme.
Questa malattia colpisce principalmente popolazioni africane, caraibiche, mediorientali, del mediterraneo occidentale e del Sudestasiatico.
Si produce una cellula di globulo rosso che ha una insolita forma che ha un tempo di vita inferiore e può causare ostruzioni nelle arterie e vene.
L’emoglobinaS si origina da una mutazione di un singolo amminoacido nelle catene Beta. Gli eterozigoti che hanno un gene buono ed uno mutante sono per lo più sani. Gli omozigoti che hanno due geni mutanti soffrono della malattia.
I portatori di questa mutazione però sono resistenti alla malaria e nelle aree endemiche della malaria c’è un’alta frequenza dei portatori di anemia falciforme.
Quando l’emoglobinaS non è legata allo ione Ferro II, l’emoglobinaS polimerizza in lunghe fibre proteiche che distorcono la forma dei globuli rossi ad una forma a falce. Questi globuli rossi tendono ad intasare i capillari che si rompono spesso.
Un globulo rosso normale vive attorno a 120 giorni, tempo che si riduce ad appena 20 se si tratta di un globulo falciforme. La conseguenza è l’anemia.
L’emoglobina delle persone affette da Anemia Falciforme presenta una variazione genetica sulla posizione 6 delle catene beta dell’emoglobina. In essa un acido glutammico (caricato negativamente) viene sostituito da una apolare, che visualizziamo in BIANCO.
Questo a sua volta costringe il gruppo idrofobico, costituito dagli amminoacidi apolari Leucina 88 e Fenilalanina 75, che legano il gruppo EME, a venire fuori e stare a contatto con l’acqua. .
questi particolari (in BIANCO gli AA idrofobici) della emoglobinaS singola.
Proprio gli amminoacidi Leucina 88 e fenilalanina 85 sono stati definiti cruciali nella possibilità di polimerizzare di questa unità biologica di Hemoglobina S proprio nelle estremità apolari. Di seguito la versione della Hemoglobina S dimera.
Versione in trace Visualizza la . Visualizza Superficie Idrofobica in bianco.
Nell’immagine di fianco sono visualizzate solo 8 molecole per ognuna in modo semplificato. Ma nella realtà l’emoglobina falciforme, perché assume la forma di una falce e costringe a modificare il globulo rosso che la contiene, è una fibra che consiste di 7 paia di filamenti ed ogni filamento contiene 1000 molecole.
Un video in inglese sull’anemia falciparia la si può trovare qui