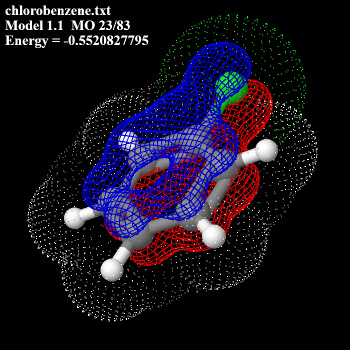
Per una sua comprensione si rimanda ad un ottimo sito, Chimica Organica Virtuale, mentre qui esaminiamo gli aspetti orbitalici di alcune strutture in cui è presente la risonanza e gli aspetti di densità di carica. I files sono stati presi dal sito chemmagic.com che ringraziamo.
L’ Effetto mesomerico produce come risultato delle interazioni tra elettroni Pgreca un eccesso o una deficienza di elettroni a seconda della natura dei sostituenti.
Se un sostituente ha un doppio legame o elettroni di nonlegame legati ad un sistema coniugato, si avrà un cambio di densità elettronica nel sistema Pgreca.
Questo effetto è del tutto differente dall’effetto induttivo che si trasmette attraverso i legami SIGMA a causa della differenza di elettronegatività o diversa ibridazione.
Si prendano in esame il fenolo e nitrofenolo, mostrati giù.
Il Gruppo OH è un gruppo che aumenta la densità elettronica (+M) sull’anello aromatico perché ha un doppietto di non legame sull’Ossigeno che può essere condiviso o delocalizzato sull’anello.
Il gruppo -NO2 ha un forte effetto (-M) e decresce la densità elettronica sull’anello.
Forza dell’effetto mesomerico per +M
-O- > -NH2 > -OR > -NHCOR > -OCOR > -Ph > -CH3 > -I > -Br > -Cl > -F
Forza dell’effetto mesomerico per -M
-NO2 > -CN > -SO3H > -CHO > -COR > -COOCOR > -COOR > -COOH > -CONH2 > -COO-
In conseguenza di questo trasferimento di elettroni si possono scrivere i cosidetti ibridi di risonanza che contribuiscono a descrivere la molecola reale, la cui energia è inferiore ad ogni singolo ibrido.
La risonanza o l’effetto mesomerico è tanto più importante quanto più simili sono gli orbitali atomici o molecolari coinvolti.
La risonanza del -F con il C è più forte di quella che il Cl può dare perché appartengono allo stesso periodo, e a parità di periodo conta la differenza di elettronegatività.
La differenza tra l’energia stimata attraverso il calore di idrogenazione e quella misurata che stabilizza una sostanza coniugata è definita energia di risonanza o di delocalizzazione.
Maggiore è l’energia di risonanza maggiore è la stabilità della molecola.
Ricordiamo solo che la risonanza e gli orbitali molecolari sono due modi di trattare lo stesso fenomeno che giungono a medesime conclusioni.
La fondamentale differenza è che la risonanza è più facile da maneggiare ed è facile da usare per visualizzare tante proprietà di una molecola.
Si veda questo link per il metilvinilchetone
Nella sua forma di risonanza gli ibridi sono 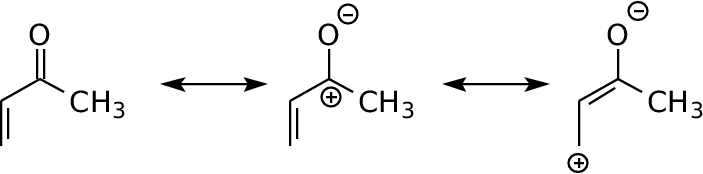 Qui presentiamo altre molecole aromatiche sulle quali è possibile ritrovare tutti gli orbitali molecolari da relazionare alle proprietà della molecola.
Qui presentiamo altre molecole aromatiche sulle quali è possibile ritrovare tutti gli orbitali molecolari da relazionare alle proprietà della molecola.