Ricordiamo che i composti su cui è presente un gruppo carbonilico possono presentare, come si è dimostrato in un altro articolo, due differenti centri di reazione: uno è il C del carbonile (sia per aldeidi, chetoni e derivati degli acidi carbossilici) che gli Idrogeni sul C adiacente al Carbonile stesso.
Di conseguenza si possono avere due prodotti differenti a seconda delle condizioni come solvatazione, forza dell’elettrofilo, stabilità del prodotto e coordinazione del catione.


Nel caso di su un elettrofilo debole come CH3I e la presenza del Na+ fanno sì che agisca il centro nucleofilo più forte a causa di uno stato di transizione meno energetico.
Nel caso del trimetilsilano, elettrofilo più forte, è l’Ossigeno che presenta uno SdT meno energetico.
In un articolo precedente che tratta della Tautomeria in ambiente basico si è posta l’attenzione più sugli aspetti strutturali che sul meccanismo di formazione e sulle conseguenze sui prodotti.
Questi infatti possono uscire come Idrogenoioni, H+, ed utilizzabili a scopo sintetico se generati con basi forti e/o ingombranti, LiOH, LDA ed altri, in cui sia presente uno ione Li+.
Per LDA si intende la Ammina di diisopropil Litio che si ottiene quando si tratta la diisopropilammina con una base forte come KH in Tetraidrofurano a -78°C.
LDA è una base energica e stericamente impedita che predilige quindi H su posizioni meno impedite stericamente che usciranno più velocemente.
LiOH è una base meno forte e piccola che porterà ad attacchi ad H in Alfa più impediti con prodotti più favoriti termodinamicamente.
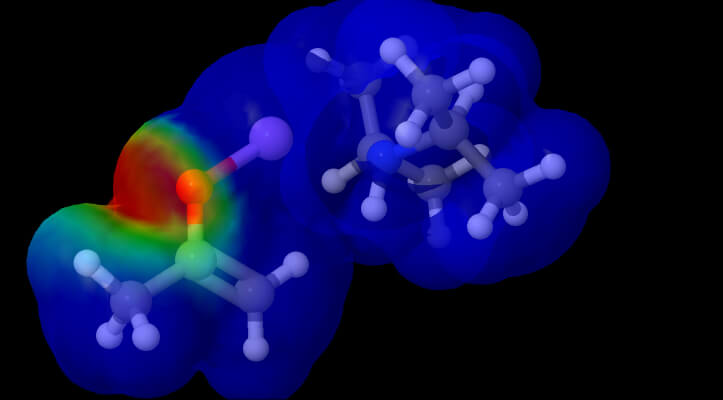
Acetone ed LDA
–
Meccanismo proposto per la reazione
– >
Etanale e LiOH
– –