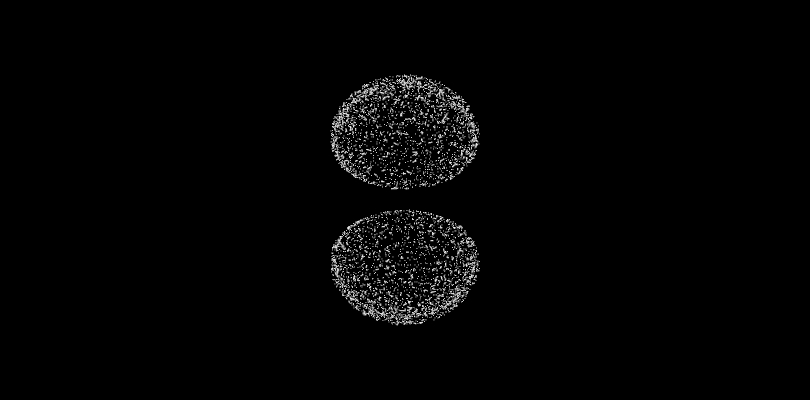
Il primo orbitale è l'unico orbitale, a simmetria sferica (l=0), del livello quantico n=1.
Questo è l'orbitale a simmetria sferica (l=0) del secondo livello quantico principale n=2. Si noti come la zona di densità elettronica sia compresa tra due superfici, a differenza dell'1S.
Al livello n=2 appartengono i sottolivelli l=0 ed l=1. Quest'ultimo è raffigurato nell’applet a destra. Ce ne sono 3 orientati nelle direzioni dei tre assi cartesiani.
Al livello n=3, appartengono i sottolivelli l=0 sferico, l=1 di tipo p, ed l=2 di tipo d. In complesso sono 5 orbitali di tipo d. Il primo 3dz2 diretto lungo l'asse z , un altro lungo gli assi x e y., ed altre 3 sui tre piani descritti dagli assi cartesiani.
Orbitali atomici non ibridi del Cloro
Di seguito proponiamo gli orbitali atomici naturali del Cloro del terzo periodo che ha la configurazione elettronica dei suoi 17 elettroni [Ne]3s2-3p5 (1s2-2s2-2p6-3s2-3p5). Come tutti gli alogeni si può vedere che ha 5 elettroni sul livello P.
Gli orbitali 4S 3P e 3D saranno perciò vuoti.
https://commons.wikimedia.org
Si veda questa pagina in Inglese sugli orbitali atomici più comuni del Cloro