Importanti chimici moderni ne hanno sottolineato l’importanza, l’utilità e l’attualità di questa reazione, come Woodward, premio nobel nel 1965, e Corey premio Nobel nel 1990.
La reazione di Diels Alder avviene tra un diene coniugato ed un dienofilo per formare un cicloesene ed è anche detta cicloaddizione 4+2.
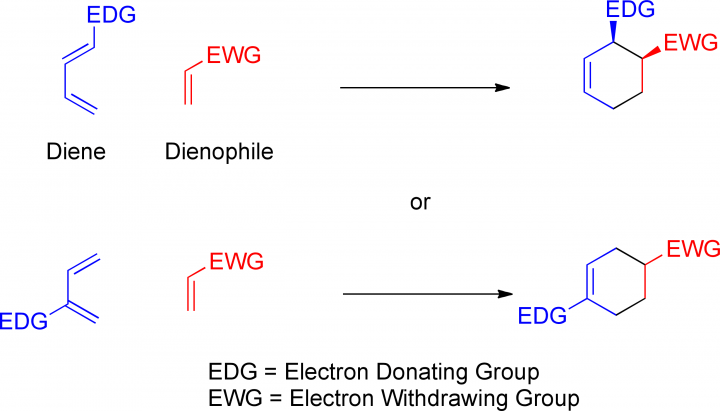
Il diene può contenere gruppi Elettron Donatori(EDG), mentre il dienofilo contiene gruppi elettronattrattori (EWG).
La variazione di questi gruppi e la stereospecificità di questa reazione portano ad una vasta serie di prodotti. C’è ancora molta discussione sulla previsione e sulla teoria di questa reazione.
La reazione di Diels Alder coinvolge sempre la rottura di 3 legami Pgreco e la formazione di 3 nuovi legami, due signa ed un pgreco. Si formerà un anello a sei atomi.
La stereochimica del dienofilo è conservata. Un arrangiamento dei gruppi attorno al doppio legame di tipo cis comporterà un arrangiamento cis nell’anello a sei atomi. In modo analogo trans-trans.
Per i dieni i due gruppi esterni sui dieni ad ogni estremità finiscono sulla stessa faccia del nuovo cicloesene formatosi.
C’è da dire che il dienofilo può addizionarsi in due modi possibili per produrre due diasteroisomeri differenti. In uno il gruppo elettronattrattore è orientato verso il nuovo doppio legame che si forma, e si parla di stereochimica ENDO. Nell’altro modo punta lontano ed è la stereochimica ESO.
Sulla stereochimica ENDO ESO dedicheremo un altro post.
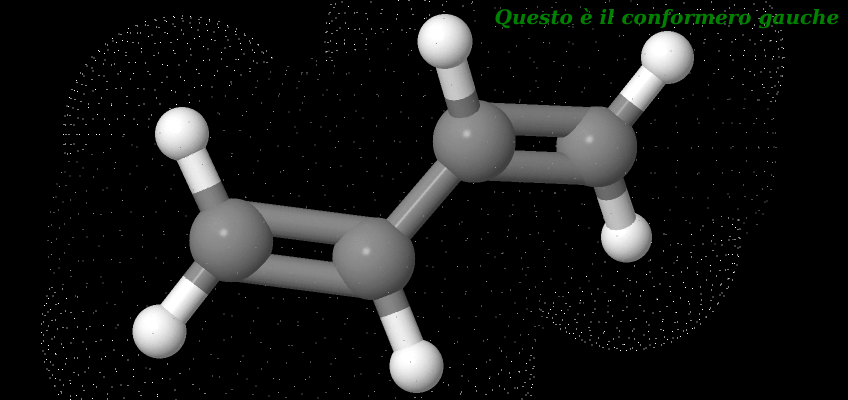
La molecola del butadiene presenta la libera rotazione attorno al legame C2-C3 che è un legame singolo, formando due conformeri con diversa energia, S-CIS ed S-TRANS. Notando la si può vedere come nell’isomero S-CIS ci sia una maggiore repulsione sterica rispetto alla S-trans tra gli H terminali. Il conformero prevalente sarà perciò S-TRANS. La differenza di energia tra le due conformazioni è di 3.88 kcal/mole, mentre la repulsione degli idrogeni nella S-CIS è di 0.36 kcal/mole che costringe la molecola ad assumere . Ciò non toglie che la molecola che dà la reazione di Diels Alder sarà S-CIS.
Ora proviamo a visualizzare la Diels Alder più semplice tra . Qui possiamo vedere l’ordine con cui si spostano i legami nella .
Questo invece è lo stato di transizione dove si può notare la distorsione degli angoli dii legami.
Come abbiamo scritto prima ci sono due modi di attacco differente a seconda di come i due reagenti si incontrano. Avremo perciò la formazione di due composti DIASTROISOMERI differenti, separabili con i metodi fisici.
ADDIZIONE a formare l’ENDO composto, più favorito
– .
ADDIZIONE a formare l’ESO composto, Meno favorito
– .
Per osservare meglio il meccanismo delle reazioni di ciclizzazione Diels ALder potete consultare due siti tra i tanti: Quello del prof. Gablek e il sito di Nick Greeves, da dove ho preso l’animazione della Diels Alder seguente.
Un’altra pagina molto interessante e completa la si può trovare su stereoelectronics.org