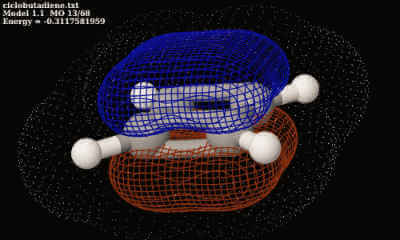
Orbitali atomici ibridi più comuni in JSmol
Nella applet seguente verranno visualizzati gli orbitali atomici ibridi più tipici del legame chimico, e considereremo un elemento generico del II periodo della Tavola Elettronica, a cui appartiene il Carbonio. L’ibridizzazione è una combinazione lineare di orbitali atomici naturali utile a spiegare sia la lunghezza dei legami sia gli angoli… Read More »Orbitali atomici ibridi più comuni in JSmol