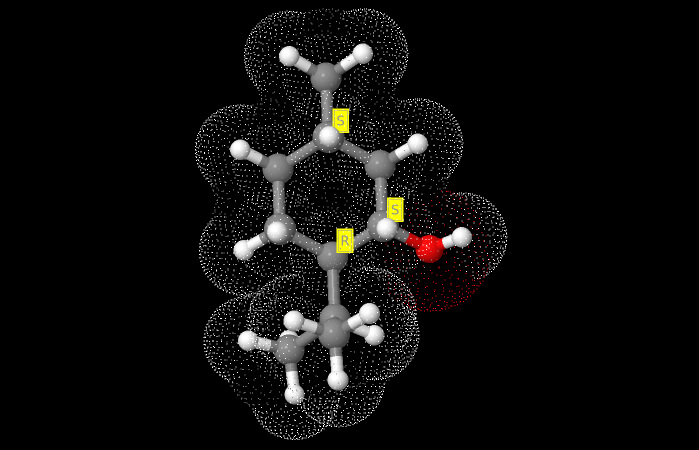
Centri stereogenici diversi dal Carbonio asimmetrico con le aziridine
In questo articolo parliamo di Aziridine che hanno centri stereogenici differenti dal Carbonio asimmetrico, come possono essere in taluni casi anche l’atomo di Azoto N e l’atomo di fosforo P.
In altri articoli si è spesso associata la chiralità esibita da una molecola alla presenza di un centro stereogenico, il C asimmetrico, anche se si è specificato che non è essenziale alla presenza della chiralità, vedi capitolo alleni.
Ricordiamo che la chiralità è definita dalla non sovrapponibilità di due immagini speculari e questa condizione non è unica del C asimmetrico ma di qualunque atomo, come azoto, fosforo, silicio che possono formare strutture tetraedriche, simili a quelle del Carbonio.
Prendiamo in considerazione l’atomo di Azoto N, a cui sono legati 3 gruppi differenti.
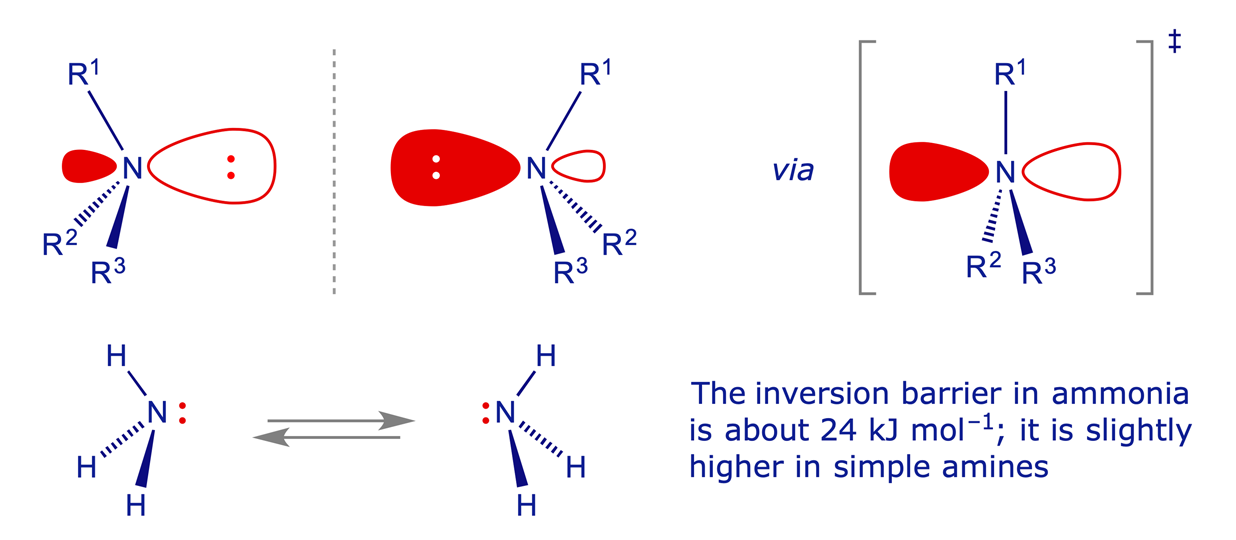
L’azoto esibisce un continuo movimento di inversione di struttura, flip-flop, a temperatura ambiente che fa trasformare i due antipodi ottici uno nell’altro. Il risultato finale è che la soluzione non è otticamente attiva.
Se invece inglobiamo l’atomo N in un anello a tre, la barriera energetica di conversione tra i due isomeri è più alta. Un altro modo di alzare la barriera energetica è di legare all’azoto un atomo più elettronegativo come un Ossigeno oppure un cloro. In questo caso il doppietto sp3 dell’azoto risulta più vicino al nucleo di N a causa degli effetti induttivi e fa aumentare la barriera energetica.
Questi composti sono stati studiati da un gruppo di ricercatori italiani che hanno studiato queste strutture particolari e prodotto un lavoro su queste molecole.
Hanno misurato la cinetica di inversione stereochimica in solventi diversi e determinando il periodo di emivita.

Come si può vedere aumentando la temperatura il tempo di sopravvivenza degli enantiomeri diminuisce sempre più perché si interconvertono.
Studi simili portano ad analoghi risultati con i composti dello zolfo come solfossidi e del fosforo, le fosfine.
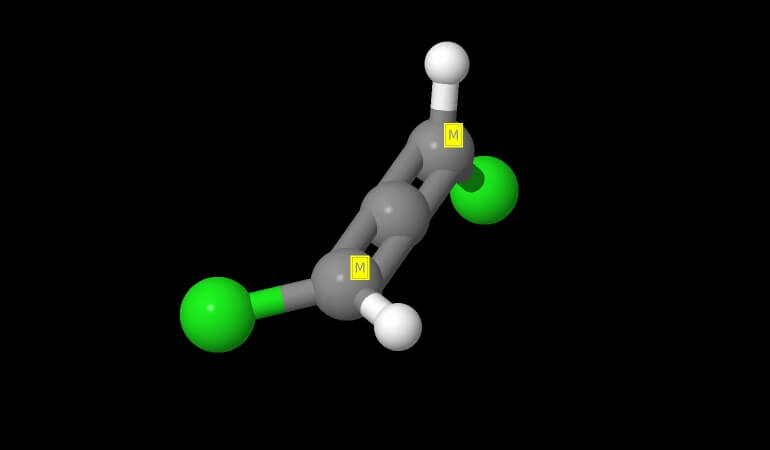
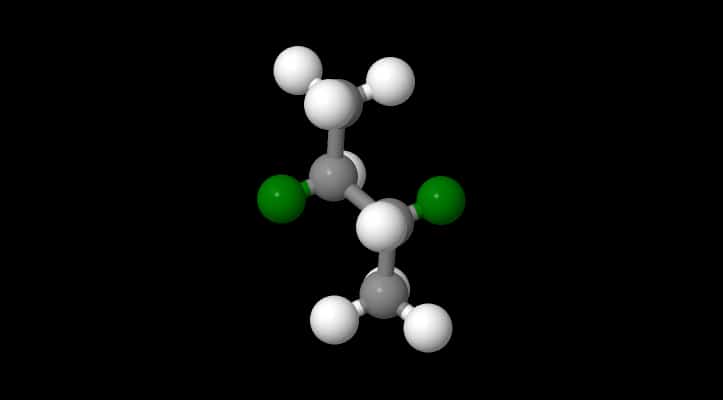
Di seguito vediamo la struttura dei due enantiomeri del 1,N Cloro-2,2difenilaziridina.