La Teoria del VSEPR è essenzialmente una variante della legge di Coulomb, secondo la quale cariche elettriche di segno opposto si respingono.
Per rendere minima l’energia di repulsione tra i doppietti elettronici, di legame come di non legame, bisogna rendere massima la distanza tra i doppietti liberi o di legame.
Questi assumeranno perciò precise configurazioni GEOMETRICHE con angoli e lunghezze di legame ottimali.
Alla determinazione di questa configurazione contribuiscono i legami SIGMA e doppietti solitari. Non contribuiscono i doppi legami.
La presenza di un doppietto libero piuttosto che un legame SIGMA produce spesso un restringimento dell’angolo di legame perché i doppietti liberi sono più espansi e meno circoscritti del legame SIGMA.
Nel caso degli elementi del II gruppo il numero massimo di elettroni sono 8 e di gruppi legati sono 4.
Un atomo centrale che abbia 4 legami SIGMA avrà una struttura geometrica di tipo tetraedrico ed angolo di legame attorno ai 109°30′.
La presenza di un doppietto libero in questa configurazione produce una chiusura dell’angolo che va a 107° nel caso dell’Ammoniaca.
Un altro doppietto in più farà restringere ancor di più l’angolo portandolo a 104°30′.
Nel caso del H2S, in cui i doppietti sono ancor più espansi per il maggior numero quantico principale, l’angolo scenderebbe a 90°
Nella struttura tetraedrica l’atomo centrale si pone al centro di un cubo e i gruppi legati ai quattro angoli del cubo.
Nel caso si abbiano tre atomi legati ad un atomo centrale si parla di Geometria Trigonale Planare con angoli di 120° e legami posti tutti su uno stesso piano. La presenza di un doppietto solitario non influenza affatto l’angolo di legame che resta perciò di 120°.
Il caso più semplice è quello della CO2, biossido di carbonio, che deve sistemare solo due legami SIGMA. La distanza maggiore a cui la repulsione è minima si ha quando l’angolo di legame O-C-O è 180°.
La geometria molecolare è lineare, come quella elettronica. L’ibridazione in questo caso è detta SP. La geometria si mantiene se una molecola ha invece un legame ed un doppietto.
In questo caso la molecola, BF3, ha tre legami SIGMA e nessun doppietto solitario. La repulsione minima la si raggiunge con angoli F-B-F di 120°. Se una molecola ha due legami SIGMA ed un doppietto, la geometria e l’angolo non cambia.
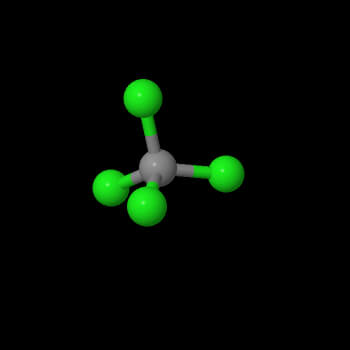
In questo caso ci sono 4 legami SIGMA, oppur quatrro doppietti di legame o non legame. la repulsione minima è raggiunta per un angolo di 109°30’se si hanno quattro legami SIGMA uguali come nella molecola del CCl4. Struttura tetraedrica, ibridazione SP3. Nel caso un legame è sostituito da un doppietto, come, allora l’angolo di legame H-N-H si restringe perché si suppone che la repulsione del doppietto è maggiore. La struttura geometrica viene chiamata piramidale, l’ibridazione è SP3
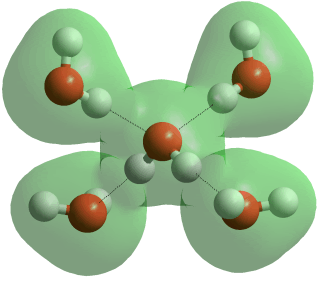
Nel caso dell’acqua la repulsione è ancora maggiore per la presenza di due doppietti e l’angolo si chiude fino a 104°,30′. L’Ibridazione resta sempre SP3, la struttura è detta tetraedrica.
Esistono anche altre strutture per atomi dei periodi superiori al secondo che possonno dare anche fino sei legami e coinvolgono orbitali di tipo d nella ibridazione. Struttura bipiramidale a base triangolare come la molecola . Qui la somma di legami e doppietti fa cinque. Nel caso del XeF2 ci sono due F e tre doppietti che si dispongono sul piano.
Nella bipiramidale a basa quadrata come la somma di doppietti e legami deve fare 6. Di seguito è la molecola del che presenta 4 legami SIGMA e due doppietti di non legame.
Per avere idea della diversità di strutture possibili in natura, si dia un’occhiata al sito COOL MOLECULES