Home » Chimica Organica » Pagina 5 Chimica Organica
Categoria per articoli di chimica organica cheorg da alcani, alcheni fino ad acidi ed esteri, zuccheri semplici e complessi visti nell’ottica della visualizzazione tridimensionale delle molecole, delle strutture, dei meccanismi.
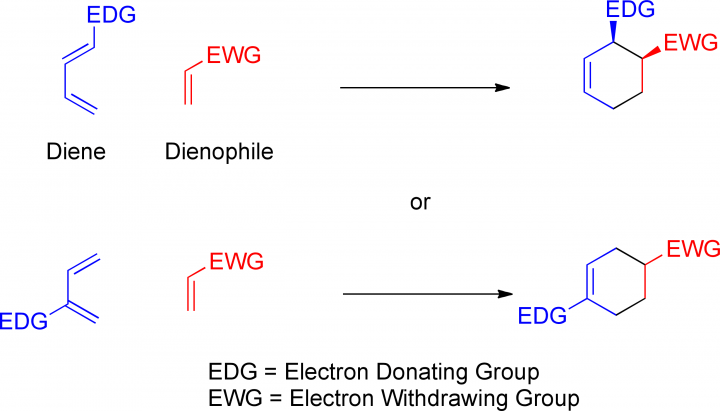
Saranno presentati meccanismi delle reazioni fondamentali della chimica organica con animazioni quanto più fedeli a quelli presentati nei libri di testo.
Sostituzioni, eliminazioni addizione, carbocationi, carboanioni radicali liberi, discussione su controllo termodinamico e controllo cinetico dei processi.
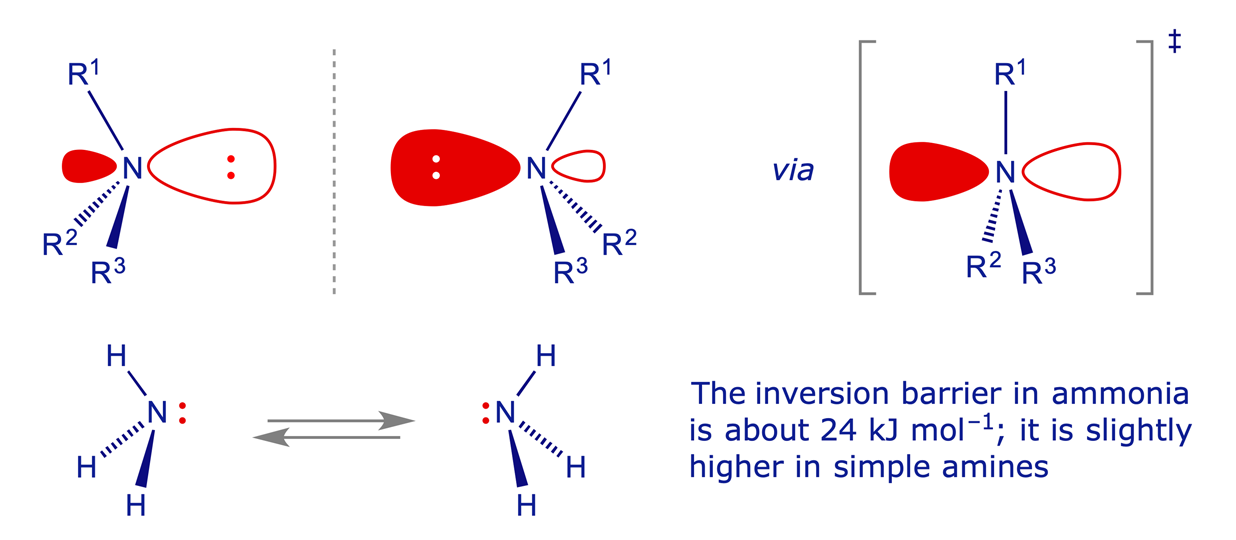
Un tema grosso trattato è l’isomeria, di struttura, di catena, conformazionale e configurazionale. Spazio è dato alle regole CIP, Cahn, Ingold e Prelog per assegnare la configurazione assoluta.
L’importanza della visualizzazione non deve far tralasciare lo studio dal libro di testo.
Ci saranno anche problemi a scelta multipla
Si proporrà la sintesi industriale di alcuni prodotti chimici, le strutture di molecole odorose, o di medicinali, o di enzimi ed ormoni, di molecole comuni.
C’è anche la possibilità di costruire una molecola in 2D e visualizzarla in 3D, individuando sia l’eventuale configurazione assoluta che costruendo le mappe elettrostatiche molecolari.
Della molecola costruita è possibile salvare il formato o l’immagine in jpg
Benzene: Struttura, Orbitali molecolari, superfici elettrostatiche
Sostituzioni Elettrofile aromatiche
Aromaticità e antiaromaticità